钟涛团队揭示Gridlock/Hey2在心脏再生中的分子屏障机制
作者:luojiao 发布时间:2021/4/1 3:00:00
撰文 | 高邦君
成年哺乳动物心脏受损后再生能力有限,受损后心肌细胞被纤维疤痕取代,最终导致心力衰竭。与哺乳动物心脏不同,斑马鱼心脏损伤后可以通过心肌细胞去分化和增殖实现心脏再生;新生小鼠在出生一周内,损伤的心脏也可以通过心肌去分化和增殖完成再生[1]。哺乳动物心脏再生能力有限,主要是由于细胞内在再生屏障与分子阻滞因子的存在,这些再生障碍和负调控因子会阻碍心脏受损后心肌细胞去分化和增殖。
2020年9月,华东师范大学上海市调控重点实验室钟涛教授团队在Development上发表了题为The Gridlock Transcriptional Repressor Impedes Vertebrate Heart Regeneration by Restricting Expression of Lysine Methyltransferase的研究论文,揭示了Gridlock(Grl)介导的转录调控在心脏再生与修复过程中具有分子屏障作用及负调控机制。Grl是一种bHLH转录抑制因子,属于Hey/Hrt基因家族。Grl/Hey2在心血管发育和稳态维持中,对动静脉内皮细胞分化,心脏房室交界形成以及心肌小梁发育中发挥重要作用,但在心脏损伤修复和再生过程中的作用与机制尚未清楚。
作者构建了在心肌细胞中条件性诱导grl表达的转基因斑马鱼,发现成体心肌中过表达grl能够抑制受损后心肌细胞去分化与增殖(图1);反之,grl突变减少纤维化疤痕和促进心肌细胞增殖,增强心脏再生。进一步研究表明,赖氨酸甲基转移酶Smyd2在受损心肌中的表达直接受到Grl介导的转录抑制,E-box是Grl结合在Smyd2启动子的关键位点。心脏损伤会诱导grl表达下降,直接引起smyd2在心肌层中表达升高。功能研究证明抑制Smyd2甲基转移酶活性阻碍受损心肌细胞的去分化和增殖能力。
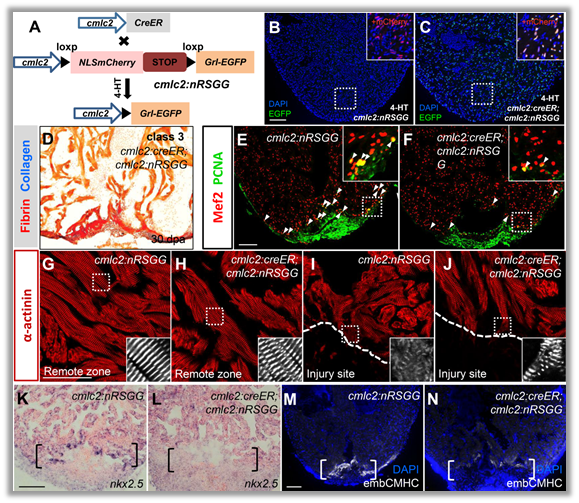
图1在成年心肌层中诱导grl过表达抑制再生过程中心肌细胞去分化和增值
Smyd2作为赖氨酸甲基转移酶如何通过组蛋白或非组蛋白甲基化在心脏再生中发挥作用?作者发现,H3K4和H3K9甲基化在grl突变体或过表达心脏中没有变化,而Stat3甲基化和磷酸化水平在grl突变体心肌损伤部位中显著升高。有趣的是, Stat3磷酸化是由甲基化自身诱导引起。研究表明,在心脏再生过程中,Smyd2通过与转录因子Stat3相互作用,调节Stat3甲基化和磷酸化,从而增强受损心肌细胞去分化和更新能力。
该研究揭示心脏再生屏障与分子阻滞因子的存在,证实Grl介导的转录抑制是阻滞心脏再生的负调控程序,解析Grl-Smyd2/Stat3转录与甲基化修饰网络在心脏修复与再生中的分子机制。这些研究成果提示在受损心肌中静默Grl转录抑制可能显著增强哺乳动物心脏再生能力,为人类心脏疾病治疗提供新的启示。
华东师范大学钟涛教授为通讯作者,博士后佘培露为论文第一作者,该研究得到课题组国家科技计划项目重点专项(2018YFA0800103,2018YFA0801004)以及国家自然科学基金(NSFC31530044,NSFC31970780)资助。
参考文献:
1. Porrello, E. R., Mahmoud, A. I., Simpson, E., Hill, J. A.,Richardson, J. A., Olson,E. N. and Sadek, H. A. (2011). Transient regenerativepotential of the neonatal mouse heart. Science (New York, N.Y.) 331, 1078-1080.