井冈山大学陆辉强组揭示肢体极性再生的分子机制,发现重启肢体再生的开关
作者:luojiao 发布时间:2021/4/2 3:00:00撰文 | 陆辉强
众所周知,壁虎的尾巴断了能再生,而这种能力一旦被人类掌握,所有的患者都能重获自由。组织再生广泛存在于动物界,并因物种而异,一般低等动物拥有较强的再生能力。低等生物如涡虫在切断后具有识别向前切面(面向头部方向)和向后切面(面向尾部方向),并能在向前伤口切面和向后伤口切面再生出头部和尾部的特性,这一特性被称为“再生极性”[1-5]。然而脊椎动物肢体主要从近端方向发展到远端,关于脊椎动物是否同样具有再生极性,以及其具体的调控机制目前尚不清楚。
2021年1月12日,井冈山大学陆辉强组在PNAS在线发表题为”Calcineurin controls proximodistal blastema polarity in zebrafish fin regeneration“的研究论文,该研究组以模式动物斑马鱼为研究对象,利用独特的鱼鳍切口模型,发现斑马鱼尾鳍具有再生方向极性并阐明钙调磷酸酶(calcineurin)参与调控该方向极性。

众所周知,壁虎的尾巴断了能再生,而这种能力一旦被人类掌握,所有的患者都能重获自由。组织再生广泛存在于动物界,并因物种而异,一般低等动物拥有较强的再生能力。低等生物如涡虫在切断后具有识别向前切面(面向头部方向)和向后切面(面向尾部方向),并能在向前伤口切面和向后伤口切面再生出头部和尾部的特性,这一特性被称为“再生极性”[1-5]。然而脊椎动物肢体主要从近端方向发展到远端,关于脊椎动物是否同样具有再生极性,以及其具体的调控机制目前尚不清楚。
2021年1月12日,井冈山大学陆辉强组在PNAS在线发表题为”Calcineurin controls proximodistal blastema polarity in zebrafish fin regeneration“的研究论文,该研究组以模式动物斑马鱼为研究对象,利用独特的鱼鳍切口模型,发现斑马鱼尾鳍具有再生方向极性并阐明钙调磷酸酶(calcineurin)参与调控该方向极性。

该研究组设计了一种巧妙的研究方式,即在斑马鱼尾鳍上产生一个方形切孔,然后意外发现再生只能出现在切孔的前端切口(ACE),而后端切口(PCE)则无法再生,说明脊椎动物同样存在肢体再生的方向极性,并且这种单向再生极性发生主要是在于PCE处无法建立再生原基。随后该研究组发现钙调磷酸酶的活性控制着斑马鱼尾鳍再生方向极性,切孔产生后,ACE处钙调磷酸酶活性远低于PCE,低钙调磷酸酶活性可以诱导原基的形成并促使鳍条再生。而使用钙调磷酸酶活性药物抑制剂后,本来无法再生的PCE却重启鳍条再生的现象[6]。
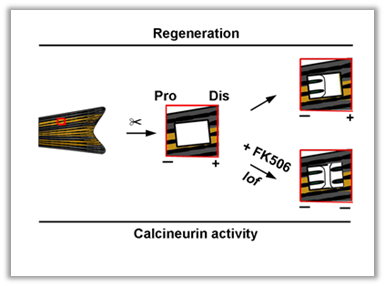
图1 独特的鱼鳍切口模型解析钙调磷酸酶参与斑马鱼尾鳍再生的方向极性
参考文献:
1. K. A. Gurley, J. C. Rink, A. S. Alvarado,.β-catenin defineshead versus tail identity during planarian regeneration and homeostasis. Science, 319, 323-327 (2008).
2. C. P. Petersen, P. W. Reddien, Smed-βcatenin-1 is required for anteroposteriorblastema polarity in planarian regeneration. Science, 319, 327-330 (2008).
3. Y. Umesono, J. Tasaki, Y. Nishimura etal., The molecular logic for planarian regeneration along the anterior–posterior axis. Nature, 500, 73-76 (2013).
4. S. Y. Liu, C. Selck, B. Friedrich et al.,Reactivating head regrowth in a regeneration-deficient planarian species. Nature, 500, 81-84 (2013).
5. J. M. Sikes, P. A. Newmark,. Restorationof anterior regeneration in a planarian with limited regenerative ability. Nature, 500, 77-80 (2013).
6. Z. G. Cao, Y. L. Meng, F. H. Gong, etal., Calcineurin controls proximodistal blastema polarity in zebrafish finregeneration. PNAS, 118(2):e2009539118.(2021)

图1 独特的鱼鳍切口模型解析钙调磷酸酶参与斑马鱼尾鳍再生的方向极性
总的来说,钙调神经磷酸酶如同一个分子开关,开关开启后将本来无法再生的肢体重启再生。该发现对于深入理解肢体再生调控机制和器官再生医学临床应用具有潜在的意义。未来,有望通过药物诱导的方式诱导人类肢体重启再生。
井冈山大学陆辉强博士为该论文的通讯作者,井冈山大学曹子岗博士、本科生孟云龙(现为赣南师范大学硕士研究生)、温州医科大学龚方华博士为该论文的共同第一作者。该研究得到了国家重点研发项目、国家自然科学基金项目和江西省自然科学基金项目的资助。
参考文献:
1. K. A. Gurley, J. C. Rink, A. S. Alvarado,.β-catenin defineshead versus tail identity during planarian regeneration and homeostasis. Science, 319, 323-327 (2008).
2. C. P. Petersen, P. W. Reddien, Smed-βcatenin-1 is required for anteroposteriorblastema polarity in planarian regeneration. Science, 319, 327-330 (2008).
3. Y. Umesono, J. Tasaki, Y. Nishimura etal., The molecular logic for planarian regeneration along the anterior–posterior axis. Nature, 500, 73-76 (2013).
4. S. Y. Liu, C. Selck, B. Friedrich et al.,Reactivating head regrowth in a regeneration-deficient planarian species. Nature, 500, 81-84 (2013).
5. J. M. Sikes, P. A. Newmark,. Restorationof anterior regeneration in a planarian with limited regenerative ability. Nature, 500, 77-80 (2013).
6. Z. G. Cao, Y. L. Meng, F. H. Gong, etal., Calcineurin controls proximodistal blastema polarity in zebrafish finregeneration. PNAS, 118(2):e2009539118.(2021)