王强/张霆/吴建新合作揭示转录因子Myoneurin在颅面软骨发育中的关键作用
作者:luojiao 发布时间:2022/6/28 5:35:00
颅面畸形主要是由于头颈部的骨骼发育异常而导致的结构紊乱,属于常见的先天性出生缺陷,约占所有新生儿出生缺陷的三分之一 [1]。在胚胎发育过程中,头颈部的颅底骨主要以软骨内成骨的方式形成,即头部腮弓内的神经嵴细胞通过迁移、增殖和分化形成软骨,随后软骨细胞肥大、凋亡并逐步被替换为骨。颅底骨发育进程从无脊椎脊索动物到脊椎动物在进化上高度保守,其中颅神经嵴细胞的命运决定由BMP、Wnt和FGF等多种信号通路协同调控 [2, 3]。王强教授课题组之前的研究表明,BMP信号在颅神经嵴细胞中的活性需要维持精确的平衡,BMP信号不足,神经嵴细胞不能正常增殖和向软骨分化,造成严重的颅面软骨缺失,而BMP信号活性过高,触发细胞凋亡 [4, 5]。然而,颅神经嵴细胞中BMP信号活性维持平衡的分子机制还需要进一步阐明。
BTB/POZ锌指蛋白家族包含一组不同的转录因子,它们可以激活或抑制不同基因的转录[6]。Myoneurin(Mynn)是该家族的成员之一,被证明在多种组织中表达,但是Mynn在发育和生理中的功能机制还不为人所知。
2022年06月17日,华南理工大学医学院王强课题组联合首都儿科研究所张霆团队及同仁医院吴建新团队合作,在Cell出版社旗下学科综合类期刊iScience发表了题为“Myoneurin regulates BMP signaling by competing with Ppm1a for Smad binding”的研究论文。该论文通过对mynn-/-斑马鱼突变体的研究,揭示了mynn在颅面软骨发育中的重要功能,发现Mynn与BMP信号胞内效应蛋白Smad1/5/9相互作用,通过阻断 Smad和磷酸酶 Ppm1a 之间的结合,阻止了 Smad蛋白去磷酸化,从而维持颅神经嵴细胞中BMP信号活性。


研究人员首先使用 Tol2 转座子介导的基因捕获技术制备了mynn-/-斑马鱼突变体,纯合体胚胎表现出多种发育缺陷,包括心包水肿、头和眼睛较小、尾巴弯曲、皮肤粗糙和严重的颅面软骨缺失。尤为重要的是,在sox10启动子驱动下,在神经嵴细胞中特异地过表达mynn可以完全恢复突变体中咽部软骨缺失,表明mynn在颅面软骨发育中至关重要(图1)。
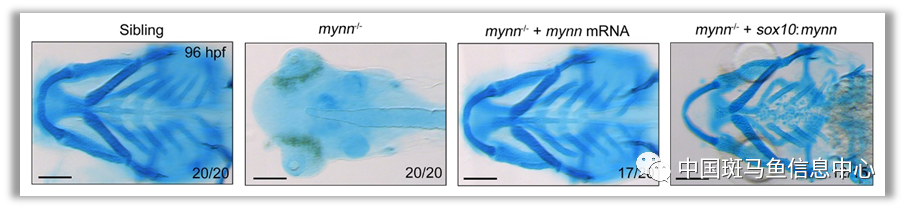
图1 mynn-/-突变体颅面软骨缺失

图1 mynn-/-突变体颅面软骨缺失
进一步研究发现,在细胞水平上mynn的缺失使神经嵴细胞增殖受阻,并且凋亡水平明显升高;与此同时,神经嵴细胞不能向软骨细胞分化。这些表型与BMP信号缺乏造成的发育缺陷非常相似。因此,研究人员推测mynn在软骨发育过程中可能通过调控BMP信号发挥作用。随后,研究人员发现,mynn-/-胚胎中BMP信号活性降低;在哺乳动物细胞中敲低mynn后Smad1/5/9的磷酸化水平也明显下降。值得注意的是,在神经嵴细胞中特异地过表达Smad1的持续激活突变体CaSmad1,可以促进突变体中神经嵴细胞的增殖,抑制其凋亡,并且拯救颅面软骨的缺失,表明在颅面软骨发育过程中Mynn对维持BMP信号活性是不可或缺的(图2)。
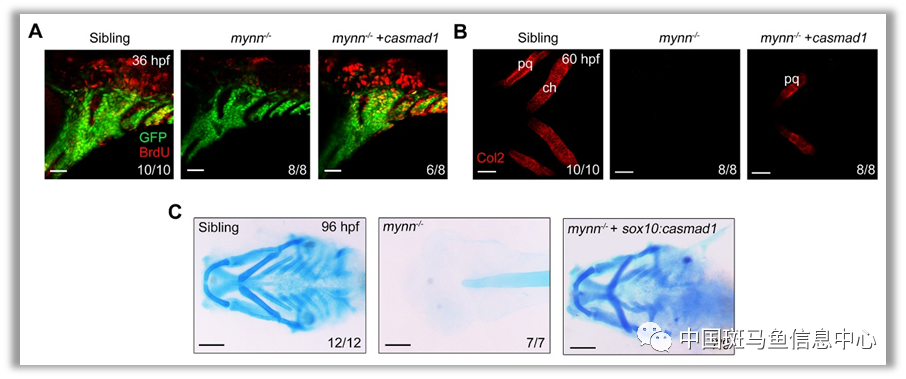
图2 Mynn通过维持BMP信号活性调控颅面软骨发育
从分子机制上,研究人员发现,Mynn可以与丝氨酸/苏氨酸磷酸酶Ppm1a竞争性结合Smad1的MH2结构域,阻止Ppm1a介导的Smad蛋白去磷酸化失活,从而维持BMP信号活性;Mynn缺失导致更多的Ppm1a与Smad结合并使Smad蛋白去磷酸化,抑制BMP信号,致使神经嵴细胞增殖和分化受阻,凋亡增加,最终导致颅面软骨缺失(图3)。该研究结果发现了Mynn在颅面软骨发育中的重要功能,并揭示了颅面软骨发育过程中维持BMP信号活性平衡的新机制。
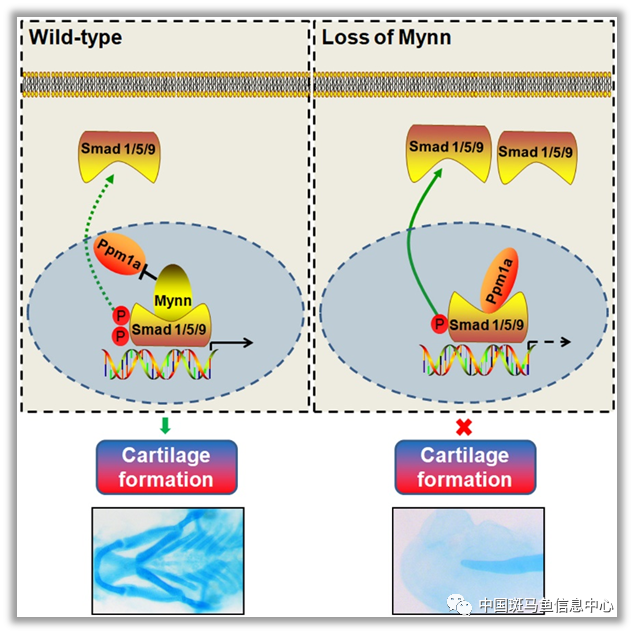
图3 Mynn与Ppm1a竞争性结合Smad1,维持BMP信号活性,促进软骨发育的模式图

图3 Mynn与Ppm1a竞争性结合Smad1,维持BMP信号活性,促进软骨发育的模式图
首都儿科研究所的杨淑艳博士为论文第一作者,中国科学院动物研究所的宁国柱博士为共同第一作者。华南理工大学医学院王强教授为通讯作者,首都儿科研究所张霆研究员和同仁医院吴建新研究员为共同通讯作者。该研究得到了国家自然科学基金委国家杰出青年基金和科技部“发育编程及其代谢调节”重点研发专项等项目的资助。据悉,该研究涉及的突变斑马鱼品系,将保藏至国家水生生物种质资源库国家斑马鱼资源中心。
参考文献:
1. JONES, N. C. & TRAINOR, P. A. 2004. The therapeutic potential of stem cells in the treatment of craniofacial abnormalities. Expert Opin Biol Ther, 4, 645-57.
2. KANZLER, B., FOREMAN, R. K., LABOSKY, P. A. & MALLO, M. 2000. BMP signaling is essential for development of skeletogenic and neurogenic cranial neural crest. Development, 127, 1095-104.
3. KELLY, K. F. & DANIEL, J. M. 2006. POZ for effect--POZ-ZF transcription factors in cancer and development. Trends Cell Biol, 16, 578-87.
4. LI, L., NING, G., YANG, S., YAN, Y., CAO, Y. & WANG, Q. 2019. BMP signaling is required for nkx2.3-positive pharyngeal pouch progenitor specification in zebrafish. PLoS Genet, 15, e1007996.
5. NING, G., LIU, X., DAI, M., MENG, A. & WANG, Q. 2013. MicroRNA-92a upholds Bmp signaling by targeting noggin3 during pharyngeal cartilage formation. Dev Cell, 24, 283-95.
6. TRIBULO, C., AYBAR, M. J., NGUYEN, V. H., MULLINS, M. C. & MAYOR, R. 2003. Regulation of Msx genes by a Bmp gradient is essential for neural crest specification. Development, 130, 6441-52.