南通大学陈罡组揭示神经祖细胞异质性及命运转换的关键分子程序
作者:CZRC 发布时间:2022/9/20 10:00:00
在发育过程中,神经祖细胞可以产生神经元和神经胶质,这是中枢神经系统复杂性的基础。以脊髓的pMN区域为例,通常认为该区域的祖细胞群首先产生运动神经元,然后产生少突胶质细胞。多年来运动神经元和少突胶质细胞的谱系(来自共同还是不同的神经祖细胞)一直存在争议。
尽管已知运动神经元和 OPCs 均可来自 pMN 祖细胞,但在体外细胞克隆实验中,也会发现中间神经元和星形胶质细胞存在于pMN 祖细胞子代克隆中,但很少有研究阐明这些谱系是如何相关的。此外,尽管研究揭示了运动神经元和 OPCs 发育的几个关键因素,但决定其命运的分子程序尚不完全清楚。传统的谱系研究方法包括体外克隆、活体成像或谱系追踪和分子程序解析很大程度上取决于报告基因,其缺少亚细胞类型的精准度,很难精确解析细胞谱系。详细分析发育中的中枢神经系统中的细胞类型,尤其是神经干细胞/祖细胞,将有助于阐明神经发生的分子机制,为靶向特定细胞类型的治疗提供借鉴。
2022年9月,南通大学陈罡教授课题组在JBC上发表了题为“Expression of myelin transcription factor 1 and lamin B receptor mediate neural progenitor fate transition in the zebrafish spinal cord pMN domain”的研究论文,该论文揭示了斑马鱼脊髓pMN 区域神经祖细胞的异质性及细胞命运转换的关键分子程序。该论文被期刊编辑选为期刊推荐文章(Editor’s Pick)。


作者通过流式分选获取斑马鱼受精后28小时、42小时和 60小时的脊髓pMN 祖细胞(olig2+),这些时期分别对应运动神经元发育活跃期、OPC形成及分化期。作者利用单细胞测序技术对 24646个细胞进行深入分析。基于基因表达谱,细胞被分为12个亚群。
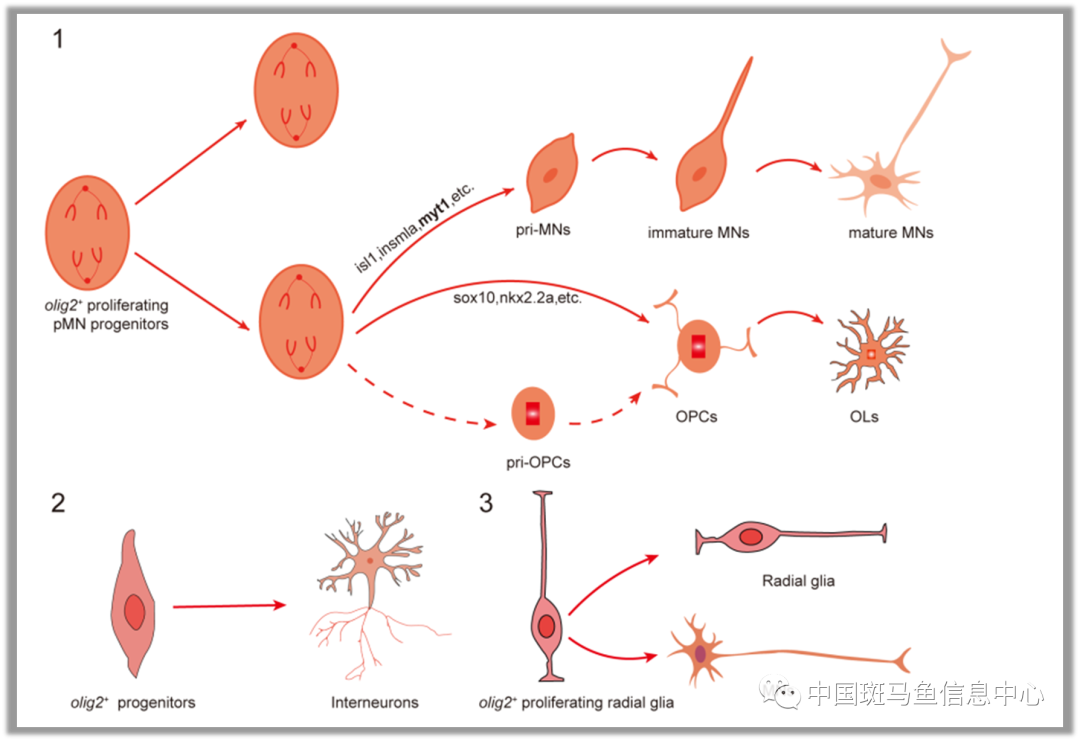
图1 olig2+祖细胞的异质性及谱系模式图

图1 olig2+祖细胞的异质性及谱系模式图
作者确定了若干种主要的祖细胞及其可能的分化命运,分别为pri-OPC, pri-MN, olig2+放射状胶质细胞及中间神经元前体,其中前两者来自传统意义上定义的pMN祖细胞。这以前关于神经元和神经胶质细胞谱系分析的研究提供了更深入的理解。有趣的是,olig2+的放射状胶质细胞亦有可能形成运动神经元,不过该谱系不同于传统的 OPC 和运动神经元谱系。也就是说运动神经元可能来自不同的祖细胞。另外作者还发现了一个独立的中间神经元谱系,它与其他三个谱系没有任何共同的祖细胞。pMN 祖细胞的异质性和不同的谱系分化为先前研究中相互矛盾的发现提供了有力的解释,同时也说明了传统意义上通过单个基因,如olig2,解析细胞命运的局限性。
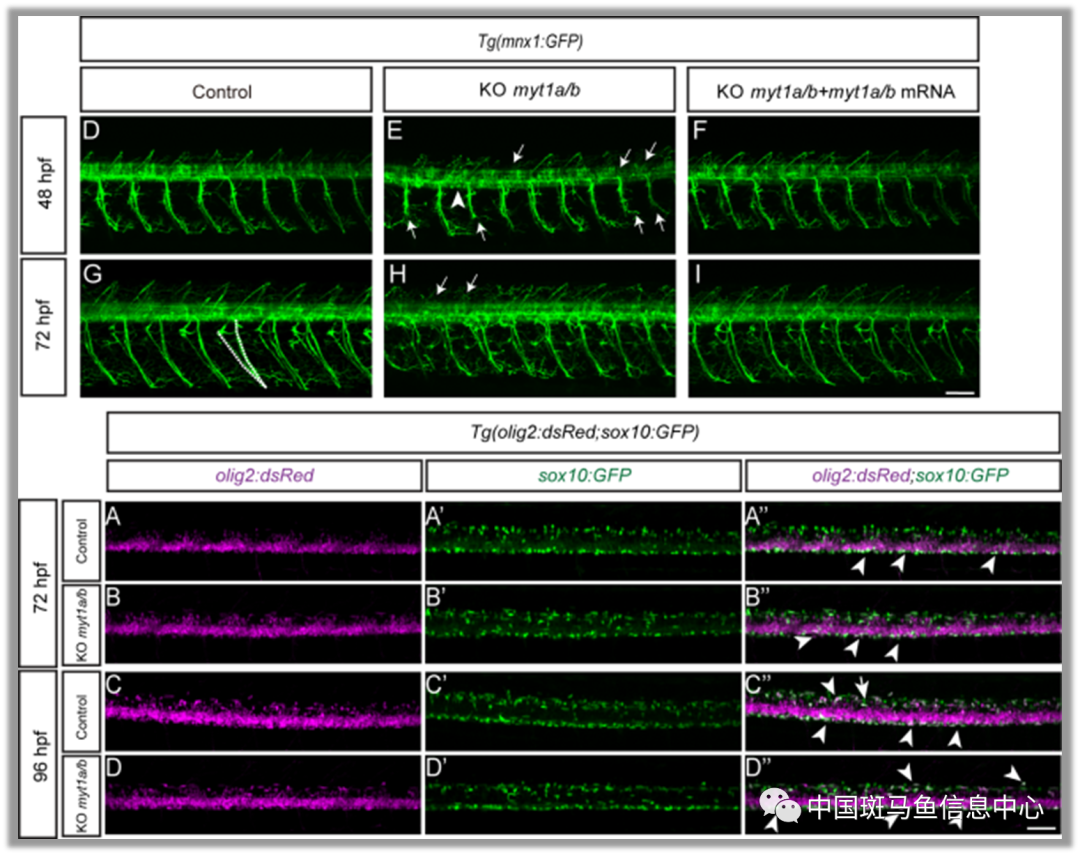
图2 myt1缺陷导致神经元发育而非OPC形成障碍

图2 myt1缺陷导致神经元发育而非OPC形成障碍
作者接着通过Monocle解析了运动和少突胶质细胞命运决定相关的转录因子。并通过实验证实了 myt1 运动神经元发育中的必要性。有趣的是,他们发现 myt1 突变体不会导致 OPC 谱系的缺陷,这暗示来自早期形成的运动神经元的信号对于 OPC 谱系的发生不是必需的,即运动神经元和OPC谱系早期就已分离。此数据与单细胞测序结果一致,pri-OPC在运动神经元停止分化前就已存在(28 hpf)。
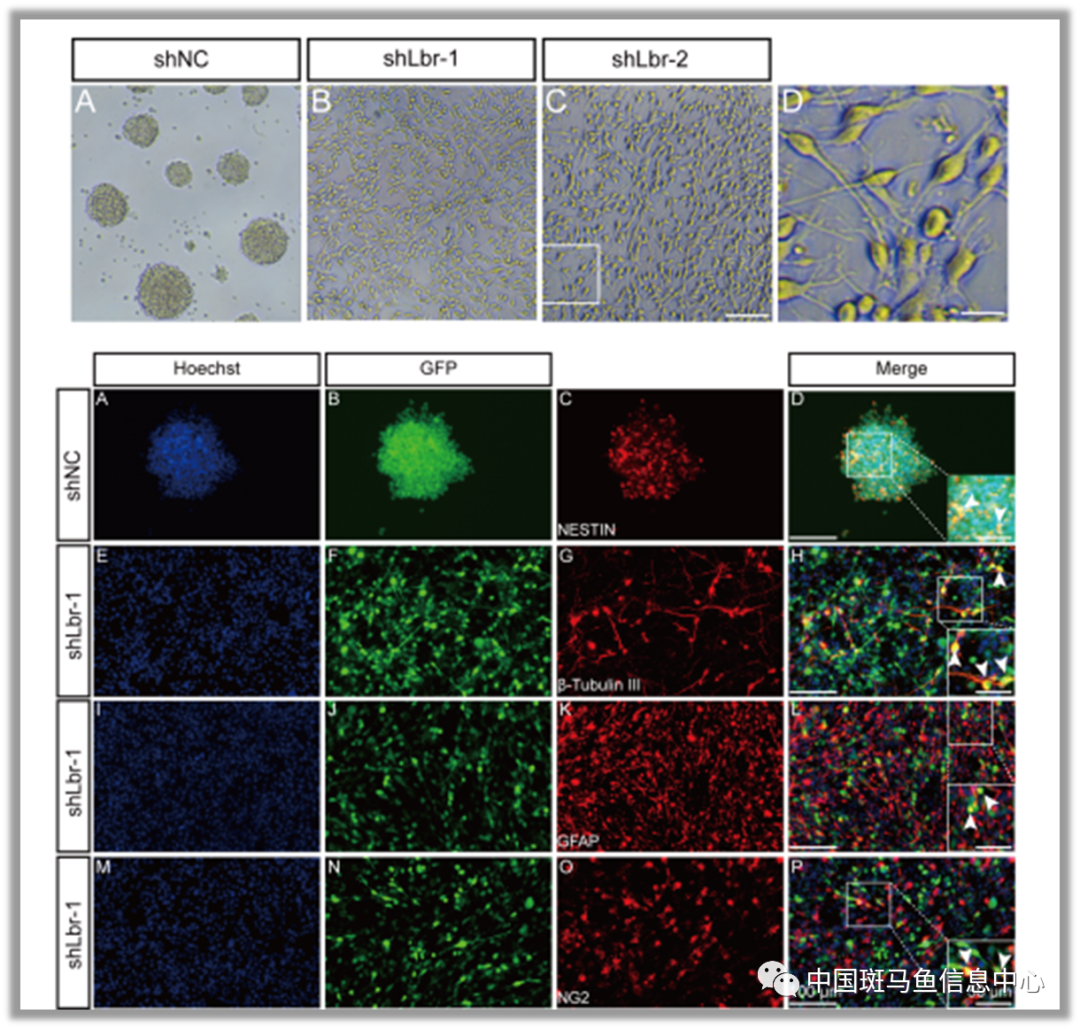
图3 Lbr缺陷导致细胞不定向分化

图3 Lbr缺陷导致细胞不定向分化
通过将传统意义上的pMN两群祖细胞解析,作者发现lbr与常见的分裂调控因子高度相关。作者通过大鼠体外培养的神经干细胞验证了Lbr在神经祖细胞干性维持中的作用, Lbr缺陷导致神经球无法形成,细胞会进行不定向分化。神经干细胞移植已被广泛用于生成神经元以替代创伤或退行性病变后丢失的细胞,其中体外细胞扩增和体内致瘤是极具挑战性的问题。低分化和高增殖率对于干细胞/祖细胞在肿瘤发生和自我更新中至关重要。基于本研究中发现的 LBR 的作用,它可能是细胞移植的潜在分子靶点。
综上,该研究对斑马鱼olig2+的祖细胞的谱系及分化命运提出来更深度的理解,为神经元的有效分化及神经干细胞的体外扩增及分化提供了更多的理论指导。
综上,该研究对斑马鱼olig2+的祖细胞的谱系及分化命运提出来更深度的理解,为神经元的有效分化及神经干细胞的体外扩增及分化提供了更多的理论指导。
南通大学邢玲燕副教授和硕士生王家琪、柴瑞为论文共同第一作者。陈罡教授和邢玲燕副教授为论文通讯作者。该论文得到国家重点研发计划和自然科学基金项目资助。