温子龙和徐进组揭示小胶质细胞进入大脑的新型分子机制
作者:CZRC 发布时间:2022/9/26 11:00:00
小胶质细胞(Microglia)是中枢神经系统的组织特异性巨噬细胞,对中枢神经系统的发育,功能和稳态维持具有非常重要的作用 [1]。与神经外胚层来源的神经细胞以及另外两种胶质细胞(星形胶质细胞和寡树突状细胞)不同,小胶质细胞来源于胚外中胚层的造血组织,在胚胎发育早期迁移到中枢神经系统,进一步特化成为了小胶质细胞 [2, 3]。然而,小胶质细胞前体是如何从外周组织进到中枢神经系统以及随后如何进行定向性分布目前尚不明确。在前期研究中,香港科技大学生命科学部温子龙教授课题组利用斑马鱼模型体外发育、胚胎透明、血液细胞发育保守等优势,系统地阐明了小胶质细胞从外周组织迁移进入大脑过程的一系列发育调控机制。研究表明,在斑马鱼模型中小胶质细胞前体首先由Il34-Csf1r信号通路诱导迁移到头部,随后在Il34-Csf1r信号和神经细胞凋亡信号的双重调控下进入中枢神经系统的各个区域 [4, 5]。其中,神经细胞的凋亡是诱导小胶质细胞进入中脑的主要原因,而溶血磷脂酰胆碱(Lysophosphatidylcholine,LPC)则是诱导该过程发生的一个重要的趋化因子[4]。虽然这些研究在一定程度上揭示了神经细胞凋亡对于小胶质细胞迁移进入大脑的重要性,但是对于凋亡的神经细胞是否会分泌其他趋化因子,小胶质细胞是否存在相应的受体分子以及受体分子上游的调控机制,仍有待进一步阐明。
2022年9月19日,香港科技大学温子龙课题组和华南理工大学徐进课题组在美国科学院院刊PNAS上在线发表了题为"Mafba and Mafbb regulate microglial colonization of zebrafish brain via controlling chemotaxis receptor expression"的论文。该研究利用斑马鱼模式生物模型, 揭示了两个关键转录因子Mafba和 Mafbb(Mafba/b)通过lysoPS-Gpr34a信号通路调节小胶质细胞迁移进入大脑的过程。


研究人员首先利用遗传学方法,发现Mafba 和 Mafbb 能够以细胞自主的方式来共同调控小胶质细胞早期发育(图1)。一旦Mafba和Mafbb功能缺失,小胶质细胞发育就会出现缺陷。通过分析Mafba/b双突变体中外周巨噬细胞的发育状况,以及利用斑马鱼活体成像技术观察追踪小胶质细胞前体的迁移过程,研究人员证实Mafba/b双突变体中小胶质细胞的发育缺陷是由于小胶质细胞前体的迁移受到了影响。进一步研究发现在Mafba/b双突变体中神经元凋亡信号通路受到抑制,而Il34-Csf1ra 信号通路维持正常。以上结果表明在Mafba/b双突变体中小胶质细胞迁移能力缺陷是因为对凋亡神经元无法产生趋化反应。
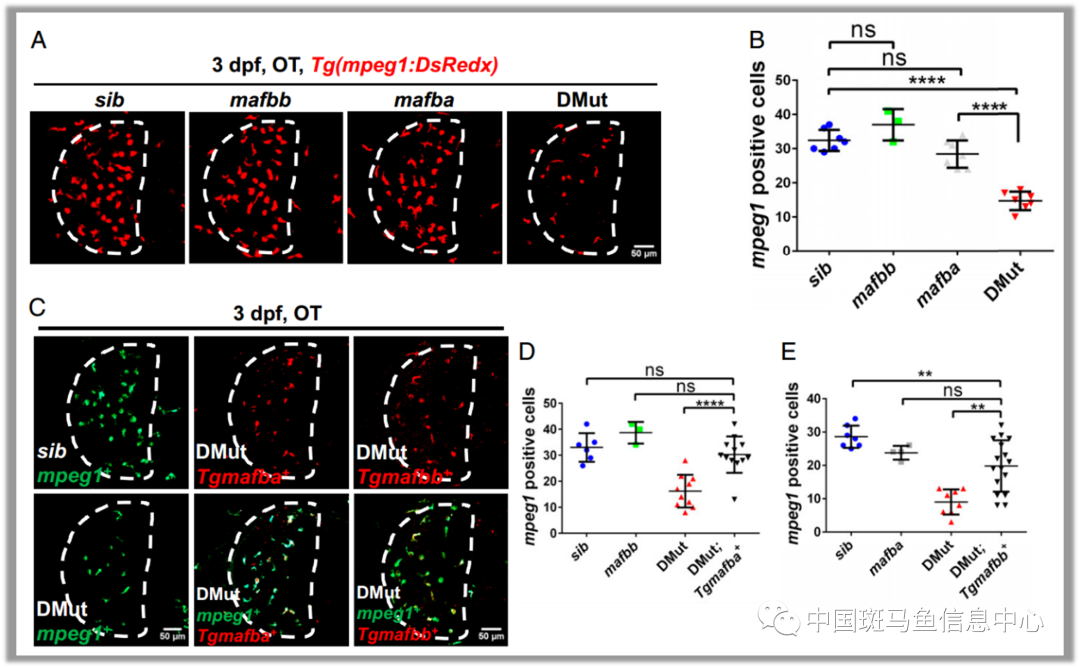
图1 Mafba和Mafbb 在斑马鱼早期发育过程中自主调节小胶质细胞发育

图1 Mafba和Mafbb 在斑马鱼早期发育过程中自主调节小胶质细胞发育
为进一步探究小胶质细胞对神经元凋亡信号没有产生趋化反应的原因,研究人员对小胶质细胞进行全转录组测序并深入挖掘(图2 A)。其中,G蛋白偶联受体34a(G protein-coupled receptor 34a,Gpr34a)引起了研究者的注意。这个受体在野生型小胶质细胞中高表达,但在Mafba/b双突变体小胶质细胞中几乎不表达(图2 B, C)。早期研究表明,哺乳动物GPR34 受体在溶血磷脂酰丝氨酸(Lysophosphatidylserine,lysoPS)的刺激下能够介导肿瘤细胞的趋化运动 [6]。通过构建过表达品系,研究人员发现在巨噬细胞中过表达 gpr34a能够部分恢复Mafba/b双突变体中小胶质细胞迁移进入大脑的能力,更重要的是,在中性粒细胞中异位表达 gpr34a 之后,原本在正常情况下不会进入大脑的中性粒细胞,也具备了迁移进入大脑的能力(图2 D-G)。以上结果表明在Mafba/b双突变体中的小胶质细胞迁移能力缺陷很大程度上归因于Gpr34a的表达缺失。此外,研究人员发现在Gpr34a斑马鱼突变体中小胶质细胞的数量有一定减少并展现出统计学差异(图2 H, I),表明Gpr34a作为关键趋化受体之一,在介导小胶质细胞进入大脑中发挥了重要的作用。

图2 Gpr34a是Mafba/b 的下游靶基因并能够促进小胶质细胞迁移进入大脑

图2 Gpr34a是Mafba/b 的下游靶基因并能够促进小胶质细胞迁移进入大脑
为进一步证实凋亡神经元通过分泌lysoPS并作用于Gpr34a受体来介导小胶质细胞迁移进入大脑,研究人员利用显微注射技术发现lysoPS能够吸引外周巨噬细胞迁移进入野生型斑马鱼大脑中,而这一趋化作用在Mafba/b双突变体斑马鱼中却基本丧失(图3)。这些结果表明,lysoPS是凋亡神经元分泌出来介导小胶质细胞迁移进入大脑的重要趋化因子,而且lysoPS-Gpr34a 信号通路受损是双突变体中小胶质细胞迁移缺陷的主要原因。

图3 在Mafba/b双突变体斑马鱼中,外周巨噬细胞丧失了对lysoPS的趋化能力

图3 在Mafba/b双突变体斑马鱼中,外周巨噬细胞丧失了对lysoPS的趋化能力
综上所述,该研究揭示了在斑马鱼早期发育过程中小胶质细胞迁移进入大脑的新遗传学基础,补充了相应的细胞分子生物学机制,对于我们理解小胶质细胞的发育和小胶质细胞-神经元的相互作用与联系具有重要意义。
香港科技大学博士生楼亮和深圳北京大学香港科技大学医学中心余涛博士为共同第一作者。该研究得到了华南理工大学徐进课题组与温子龙课题组其他部分成员的支持和帮助。
参考文献:
1. Lannes, N., et al., Microglia at center stage: a comprehensive review about the versatile and unique residential macrophages of the central nervous system. Oncotarget, 2017. 8(69): p. 114393-114413.
2. Stremmel, C., et al., Yolk sac macrophage progenitors traffic to the embryo during defined stages of development. Nat Commun, 2018. 9(1): p. 75.
3. Kierdorf, K., et al., Microglia emerge from erythromyeloid precursors via Pu.1- and Irf8-dependent pathways. Nat Neurosci, 2013. 16(3): p. 273-80.
4. Xu, J., et al., Microglia Colonization of Developing Zebrafish Midbrain Is Promoted by Apoptotic Neuron and Lysophosphatidylcholine. Dev Cell, 2016. 38(2): p. 214-22.
5. Wu, S., et al., Il34-Csf1r Pathway Regulates the Migration and Colonization of Microglial Precursors. Dev Cell, 2018. 46(5): p. 552-563 e4.
6. Iida, Y., et al., Lysophosphatidylserine stimulates chemotactic migration of colorectal cancer cells through GPR34 and PI3K/Akt pathway. Anticancer Res, 2014. 34(10): p. 5465-72.