徐晓雷/丁永和团队通过斑马鱼正向遗传学发现新的病态窦房结综合征致病基因
作者:CZRC 发布时间:2022/10/25 10:20:00
病态窦房结综合征( Sick Sinus Syndrome, SSS),又称窦房结功能障碍,是指心脏的天然起搏器(窦房结)不能够正常产生有节律的心律,从而导致心律失常的一类衰老相关的疾病。SSS 主要临床症状表现为窦性停搏、心动过缓或过速、以及房颤等。据估算,每 600名 65 岁以上的成年人中就有 1 例患SSS[1];持续有症状性的SSS 可导致心脏或身体的供血不足,严重可引起心衰和心脏骤停,危及生命。据统计,SSS也是导致患者需要植入人工起搏器的最常见适应症 [2] 。SSS具有一定的家族遗传性,可由致病基因突变所导致。有效分离发现在窦房结组织中高效表达的 SSS致病基因对易感人群的风险分级、疾病诊断并发展药物治疗靶点具有重要的理论指导意义。但是,基于SSS是一类与衰老相关、发展缓慢的疾病,加之其外显率通常较低的特点,目前已知的SSS致病基因数量非常有限,其发病的分子机制更有待进一步的阐明。
2022年10月18日,美国梅奥医院徐晓雷/丁永和等团队合作在eLife杂志在线发表了题为“A phenotype-based forward genetic screen identifies Dnajb6 as a sick sinus syndrome gene” 的研究进展 。该研究通过结合斑马鱼遗传筛选和小鼠动物模型发现并初步阐明Dnajb6是一个新的病态窦房结综合症致病基因。

在前期研究中,美国梅奥医院Stephen Ekker和徐晓雷等团队合作,在斑马鱼模式动物中建立了携带有Cre-loxP重组酶系统的、在转座子插入导致靶基因突变的同时,又可通过荧光蛋白标签来实时报告靶基因编码蛋白的时空表达模式和细胞器精确定位的、可有条件逆转的新型转座子插入诱变体系[3]。利用这一体系,该团队收集了约1200个相关的斑马鱼突变体品系,为下一步在全基因组水平上对基因的功能注释,以及研究人类相关疾病的分子基础奠定了一定的技术和资源基础。
本研究则进一步发展该斑马鱼转座子插入诱变体系,将其应用于心脏节律疾病相关的遗传学研究。研究人员首先从609个斑马鱼转座子插入突变体品系中富集了35个靶基因在心脏高效表达的突变体,然后应用心电图技术进行正向遗传学筛选,成功的分离并确认了3个突变体品系在1.5-2年龄时具有显著增加的窦性停搏的表型,类似人类衰老相关的SSS。通过对其中一个同时具有显著心动过缓表型,并在心脏特异性表达荧光报告标签的突变体品系进行详细表达谱分析发现,编码分子伴侣蛋白的Dnajb6突变靶基因在斑马鱼和小鼠模型的起搏器(窦房结)组织中具有非常独特的表达和定位模式。在斑马鱼模型中,Dnajb6可定位于窦房结和房室通道(Atrio-ventricular canal)(图1)。在小鼠模型中,Dnajb6蛋白则主要富集于窦房结,并与窦房结组织中心脏起搏细胞特异性表达的HCN4蛋白部分共定位(图2)。这些结果表明,通过斑马鱼正向遗传学筛选可有效分离发现在窦房结组织中具有独特表达模式的新型SSS致病基因。

图1 斑马鱼GBT4AA/dnajb6b突变体显示窦性停搏表型,其突变靶基因编码蛋白定位于心脏传导系统
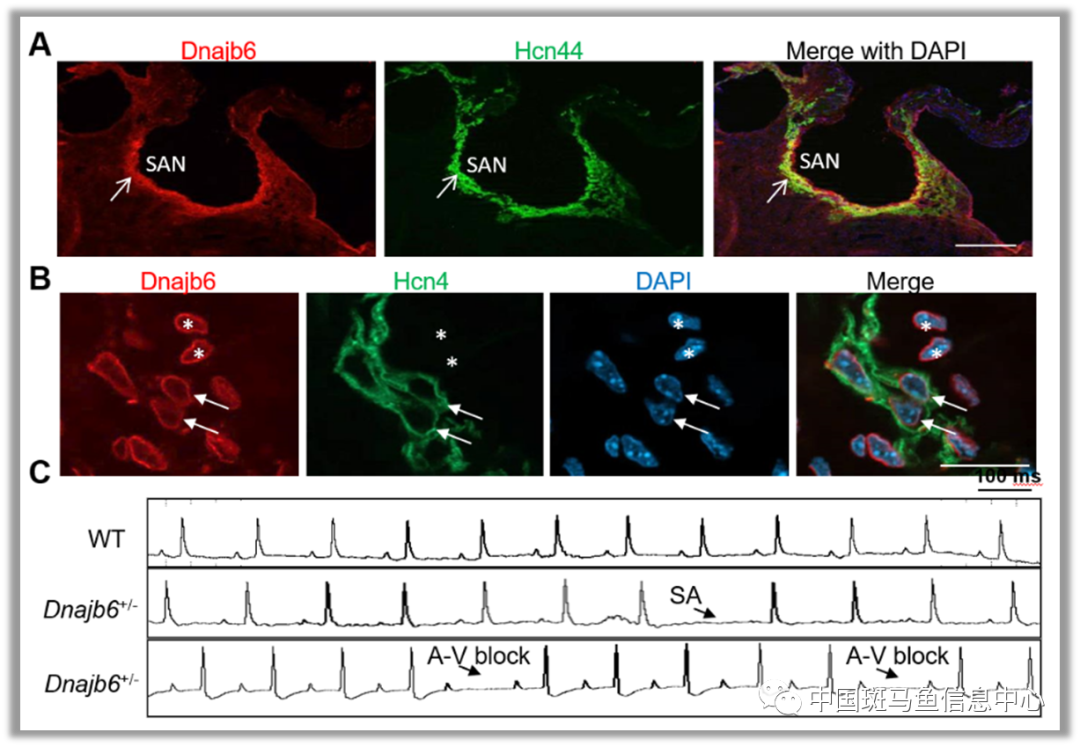
图2 小鼠Dnajb6蛋白定位于窦房结组织,并与起搏器细胞特异性表达的HCN4蛋白共定位,其基因敲除小鼠显示窦性停搏以及房室传导阻滞表型

图1 斑马鱼GBT4AA/dnajb6b突变体显示窦性停搏表型,其突变靶基因编码蛋白定位于心脏传导系统

图2 小鼠Dnajb6蛋白定位于窦房结组织,并与起搏器细胞特异性表达的HCN4蛋白共定位,其基因敲除小鼠显示窦性停搏以及房室传导阻滞表型
为了进一步阐明Dnajb6基因突变导致SSS的病理生理特征,研究人员应用高分辨率荧光光学映射(Optical Mapping)动作电位技术对该Dnajb6基因敲除的小鼠杂合子突变体的窦房结心脏起搏器功能进行了详细的电生理学研究。结果发现,与野生型对照相比,Dnajb6基因敲除小鼠具有明显心动过缓以及房室传导阻滞的表型;并且,其心率表现为更为明显的高度不规则性。进一步研究发现,与野生型对照小鼠中其起搏器大多位于解剖学和功能上定义的窦房结组织区域内不同,Dnajb6基因敲除小鼠中的起搏器大多数分布于窦房结组织之外的附属心房和房间隔等区域(图3)。这些电生理学的实验分析结果提示Dnajb6基因功能缺失突变可能导致位于窦房结组织中主导起搏器细胞受到一定程度的抑制所导致的。

图3 Dnajb6基因敲除小鼠的起搏器较为分散,多分布于窦房结组织之外的附属心房和房间隔等区域

图3 Dnajb6基因敲除小鼠的起搏器较为分散,多分布于窦房结组织之外的附属心房和房间隔等区域
研究人员进一步结合应用转录组测序、计算机模拟以及窦房结组织抗体免疫荧光染色等技术手段对Dnajb6基因突变导致SSS的分子作用机制进行了初步的研究探索。首先,通过转录组测序发现107个在Dnajb6基因敲除小鼠右心房组织中差异表达的基因。其中,钙调蛋白、离子通道编码相关基因以及Wnt/β-Catenin信号通路相关蛋白编码基因具有明显的富集。与转录组测序结果一致的是,通过计算机模拟分析发现Dnajb6基因敲除小鼠窦房结中最大电导率的L型Ca2+电流(ICa,L)、Na+/Ca2+交换器的最大传输速率以及T型Ca2+电流的电导均发现显著异常。研究人员继续通过抗体免疫荧光染色实验发现在野生型小鼠的窦房结组织中,Dnajb6 与 Tbx3 蛋白的表达水平呈负相关关系(图4)。对应的是,在Dnajb6基因敲除小鼠中Tbx3蛋白的总体表达水平呈显著降低趋势。这些结果提示Dnajb6蛋白对Tbx3蛋白的表达可能具有抑制作用。考虑到Tbx3是一个已知的决定起搏器细胞特异性的主要转录调节因子;同时,Tbx3又是Wnt/β-Catenin信号通路的一个重要转录元件;结合通过转录组测序发现Dnajb6基因敲除小鼠中钙调蛋白和Wnt/β-Catenin信号通路相关蛋白编码基因的差异表达等证据支持,研究人员设想:Dnajb6基因突变可能通过激活转录因子Tbx3的表达,进而干扰了钙离子的动态平衡,从而导致窦房结自主调节机制异常的SSS致病机理。

图4 小鼠窦房结组织中Dnajb6与Tbx3蛋白的表达水平呈负相关关系

图4 小鼠窦房结组织中Dnajb6与Tbx3蛋白的表达水平呈负相关关系
最后,为了寻求DANJB6基因突变与人SSS的临床相关性证据,研究人员分析了一个收集了6,469例SSS病例和1,000,187例对照组的全基因组关联分析(GWAS)数据库[4]。结果发现,有4个DNAJB6的变异位点与SSS具有统计学意义上的相关性(P<0.05)。其中最显著的一个变异位点:rs754941044(P=0.0193)位于潜在的剪切受体区域。因此,该剪切受体位点变异很可能对DNAJB6基因的正常功能具有显著影响。这些人类遗传学的分析结果初步提示DNAJB6基因突变与人SSS的发生具有潜在的相关性。
综上所述,该研究通过结合斑马鱼和小鼠动物模型发现并验证了Dnajb6基因是一个新的病态窦房结综合征的致病基因;该研究初步阐明了Dnajb6基因可能通过调节转录因子Tbx3的表达来调控钙离子的动态平衡,从而达到自主调节窦房结起搏器正常功能的潜在分子作用机制;本研究为应用斑马鱼正向遗传筛选从全基因组水平上系统性分离发现更多的心脏节律疾病相关的新基因提供了一个可借鉴的思路。
该论文的通讯作者是来自美国梅奥医院的徐晓雷教授;第一作者是美国梅奥医院、青岛大学的丁永和教授。上海交通大学新华医院的李毅刚教授,University of Wisconsin-Madison的 Alexey Glukhov 教授,和 University of California-Davis 的 Eleonora Grandi教授参与了此项研究。
参考文献:
1. Dobrzynski H, Boyett MR and Anderson RH. New insights into pacemaker activity: promoting understanding of sick sinus syndrome. Circulation. 2007;115:1921-32.
2. Mond HG and Proclemer A. The 11th world survey of cardiac pacing and implantable cardioverter-defibrillators: calendar year 2009--a World Society of Arrhythmia's project. Pacing Clin Electrophysiol. 2011;34:1013-27.
3. Ichino N, Serres MR, Urban RM, Urban MD, Treichel AJ, Schaefbauer KJ, Greif LE, Varshney GK, Skuster KJ, McNulty MS, Daby CL, Wang Y, Liao HK, El-Rass S, Ding Y, Liu W, Anderson JL, Wishman MD, Sabharwal A, Schimmenti LA, Sivasubbu S, Balciunas D, Hammerschmidt M, Farber SA, Wen XY, Xu X, McGrail M, Essner JJ, Burgess SM, Clark KJ and Ekker SC. Building the vertebrate codex using the gene breaking protein trap library. Elife. 2020;9.
4. Thorolfsdottir RB, Sveinbjornsson G, Aegisdottir HM, Benonisdottir S, Stefansdottir L, Ivarsdottir EV, Halldorsson GH, Sigurdsson JK, Torp-Pedersen C, Weeke PE, Brunak S, Westergaard D, Pedersen OB, Sorensen E, Nielsen KR, Burgdorf KS, Banasik K, Brumpton B, Zhou W, Oddsson A, Tragante V, Hjorleifsson KE, Davidsson OB, Rajamani S, Jonsson S, Torfason B, Valgardsson AS, Thorgeirsson G, Frigge ML, Thorleifsson G, Norddahl GL, Helgadottir A, Gretarsdottir S, Sulem P, Jonsdottir I, Willer CJ, Hveem K, Bundgaard H, Ullum H, Arnar DO, Thorsteinsdottir U, Gudbjartsson DF, Holm H, Stefansson K and Consortium DG. Genetic insight into sick sinus syndrome. Eur Heart J. 2021;42:1959-1971.