华南理工大学王强组揭示趋化因子信号协同调控弓动脉成血管细胞增殖和分化的关键作用
作者:CZRC 发布时间:2022/12/9 11:00:00
弓动脉是脊椎动物胚胎期连接心脏与背主动脉的唯一通道,最初对称生成,经过剧烈的重塑形成不对称的大动脉血管,包括主动脉、肺动脉、颈动脉和锁骨下动脉等。弓动脉形成、重塑或维持发生缺陷会引起心血管畸形。心血管畸形是常见的出生缺陷,其中心脏流出道和主动脉弓异常约占20-30%[1]。不致死的主动脉弓生成缺陷,例如血管环化等,会引起患者食管和气管的收缩,导致进食和呼吸困难,或头晕、眩晕、耳鸣,严重影响患者的生活质量[2]。因此对于弓动脉发育的研究具有十分重要的意义。
咽囊是头部组织信号中心,通过分泌BMP、PDGF、FGF等多种信号分子,调控临近组织器官的发育。近年来,王强课题组鉴定了咽囊前体细胞(PLoS Genetics, 2019),揭示了咽囊来源的BMP信号的平衡调控在颅面软骨形成中的重要作用(Developmental Cell, 2013; iScience, 2022)。此外,还发现咽囊与弓动脉在空间上邻近,咽囊来源的BMP2a和BMP5为弓动脉前体细胞的形成提供了一个合适的微环境(Development, 2020),PDGF信号则负责促进弓动脉成血管细胞增殖(Journal of Genetics and Genomics, 2019)。
在组织器官形成过程中,细胞的增殖和分化受到了严格的协同调控,对于正确形成器官结构和功能至关重要。弓动脉细胞的分化和增殖缺陷均可引起心血管畸形,但弓动脉细胞分化和增殖的协同调控机制目前却所知甚少。2022年12月5日,王强教授课题组在Development发表了题为“Chemokine signaling synchronizes angioblast proliferation and differentiation during pharyngeal arch artery vasculogenesis”的研究论文。该研究发现cxcl12b特异性表达于咽囊,是激活弓动脉成血管细胞Cxcr4a信号通路所必需的。Cxcr4a信号通过激活下游PI3K/AKT,一方面促进成血管细胞增殖,另一方面磷酸化Etv2和Scl蛋白,抑制其泛素化降解,从而协同调控成血管细胞增殖与分化,引导弓动脉形成。


Cxcl12b/Cxcr4a趋化因子信号通路在多种血管表达,参与背主动脉生成、后脑动静脉连接以及冠状动脉的形成[3-5]。王强课题组发现cxcr4a在斑马鱼胚胎咽区弓动脉动态表达,缺失cxcr4a会导致第5、6对弓动脉无血流流通,且弓动脉内皮细胞的标记基因tie1和flk表达显著降低。共聚焦显微镜观察显示,cxcr4a突变体第5、6对弓动脉成血管细胞能正常出芽与迁移,但生成的血管腔狭窄。进一步研究发现cxcr4a突变体中弓动脉成血管细胞增殖受阻(图1)。
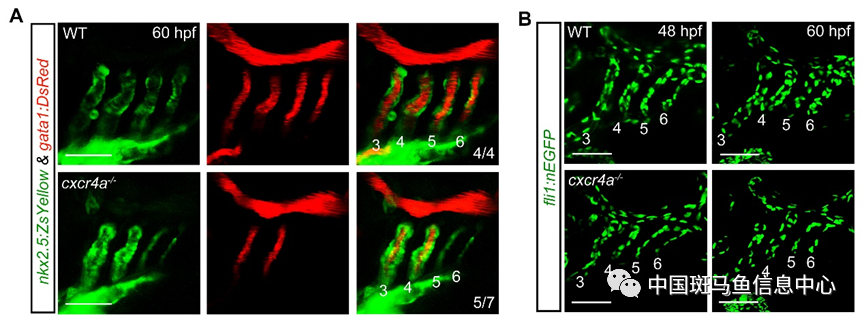
图1 缺失cxcr4a导致弓动脉血管狭窄,成血管细胞增殖受阻

图1 缺失cxcr4a导致弓动脉血管狭窄,成血管细胞增殖受阻
弓动脉细胞在快速增殖的同时分化为成血管细胞,进一步分化成为内皮细胞,其增殖不足和分化受损均会导致弓动脉形态发生失败[6,7]。cxcr4a突变体中,弓动脉的前体细胞的发育并未受到影响,但不能进一步分化为成血管细胞和终末的内皮细胞。这些结果揭示Cxcr4a信号在调控弓动脉成血管细胞增殖和分化过程中具有重要作用。
为了探究其中的分子机制,通过免疫荧光和抑制剂处理胚胎,发现cxcr4a突变体弓动脉细胞AKT磷酸化水平降低,且抑制PI3K或AKT信号均能产生突变体类似表型,而激活PI3K或AKT信号则能挽救突变体弓动脉的缺陷。此外,cxcr4a突变体弓动脉成血管细胞命运决定的关键因子Etv2及Scl蛋白表达减少。通过蛋白免疫印迹及体外磷酸化实验,发现AKT能够与Etv2及Scl结合并将其磷酸化,降低其泛素化水平,抑制蛋白降解(图2)。
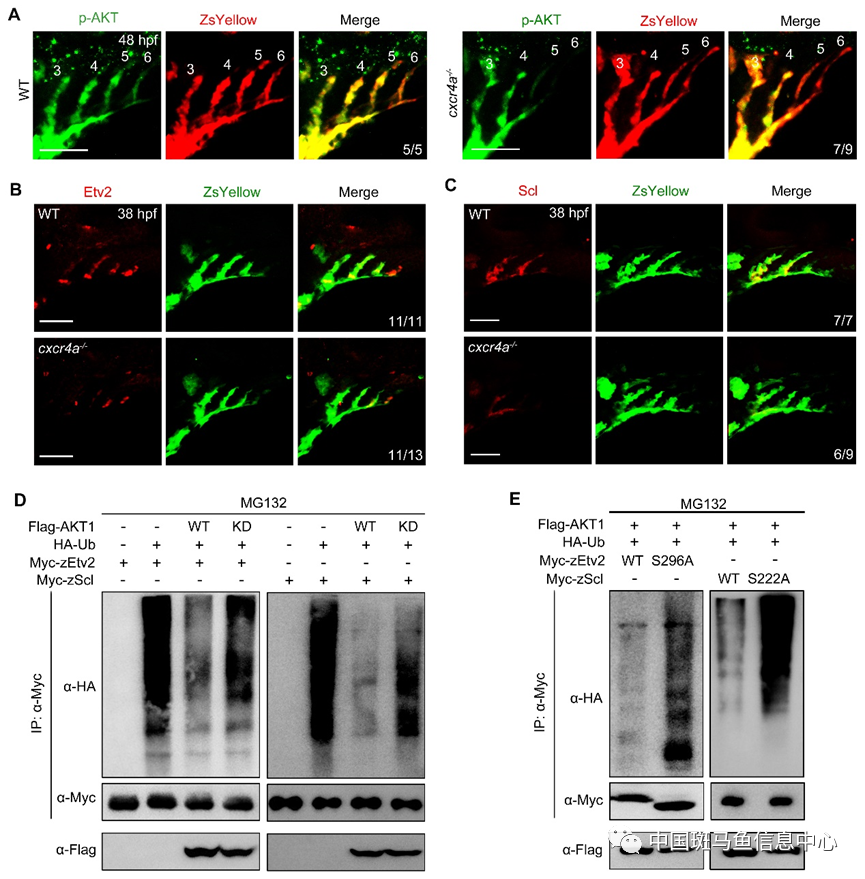
图2 Cxcr4a信号通过激活PI3K/AKT,磷酸化Etv2和Scl,抑制其泛素化降解

图2 Cxcr4a信号通过激活PI3K/AKT,磷酸化Etv2和Scl,抑制其泛素化降解
此外,荧光原位杂交和免疫荧光的结果显示Cxcr4a的配体基因cxcl12b特异性地在咽囊表达,其突变体存在类似AKT磷酸化水平降低及弓动脉发育缺陷,提示咽囊表达分泌的Cxcl12b对于激活咽弓动脉成血管细胞中Cxcr4a信号是必须的。此项研究揭示了趋化因子信号通路协调弓动脉成血管细胞的增殖与分化,指导弓动脉血管形成的关键作用。
中国科学院动物研究所刘洁博士为论文第一作者,华南理工大学王强教授为论文通讯作者。该研究得到了科技部和国家自然科学基金委的资助。
参考文献:
1. Hoffman, J.I., Kaplan, S. (2002). The incidence of congenital heart disease. J Am Coll Cardiol 39, 1890-1900.
2. Psillas, G., Kekes, G., Constantinidis, J., Triaridis, S., Vital, V. (2007). Subclavian steal syndrome: neurotological manifestations. Acta Otorhinolaryngol Ital 27, 33-37.
3. Siekmann, A.F., Standley, C., Fogarty, K.E., Wolfe, S.A., Lawson, N.D. (2009). Chemokine signaling guides regional patterning of the first embryonic artery. Gene Dev 23, 2272-2277.
4. Bussmann, J., Wolfe, S.A., Siekmann, A.F. (2011). Arterial-venous network formation during brain vascularization involves hemodynamic regulation of chemokine signaling. Development 138, 1717-1726.
5. Harrison, M.R., Bussmann, J., Huang, Y., Zhao, L., Osorio, A., Burns, C.G., Burns, C.E., Sucov, H.M., Siekmann, A.F., Lien, C.L. (2015). Chemokine-guided angiogenesis directs coronary vasculature formation in zebrafish. Dev Cell 33, 442-454.
6. Abrial, M., Paffett-Lugassy, N., Jeffrey, S., Jordan, D., O'Loughlin, E., Frederick, C. J., Burns,C.G.andBurns,C.E.(2017).TGF-beta Signaling Is Necessary and Sufficient for Pharyngeal Arch Artery Angioblast Formation. Cell Rep 20, 973-983.
7. Meng, Z. Z., Liu, W., Xia, Y., Yin, H. M., Zhang, C. Y., Su, D., Yan, L. F., Gu, A. H. and Zhou, Y. (2017). The pro-inflammatory signalling regulator Stat4 promotes vasculogenesis of great vessels derived from endothelial precursors. Nat Commun. 2017 Mar 3;8:14640.