朱学良/景乃禾组揭示脊椎动物囊胚发育中相分离调控母源mRNA的新机制
作者:CZRC 发布时间:2022/12/21 9:26:00
受精卵的基因组一开始是转录沉默的,从卵母细胞积累而来的母源mRNA随着卵裂被渐次分配到子细胞中,为早期胚胎发育提供蛋白质翻译模板。随着合子基因组激活(Zygotic Genome Activation, ZGA),基因转录逐渐旺盛,母源mRNA也被相应清除,直到胚胎完全依赖于基因组转录的mRNA。这一被称为母源-合子转换(maternal-to-zygotic transition)的过程,在不同物种中差异很大。比如斑马鱼胚胎对母源mRNA的依赖从1-细胞期至少持续至1000-细胞期,而小鼠胚胎在2-细胞中期后母源mRNA便大量降解[1, 2]。母源mRNA的蛋白质翻译活性和稳定性受到精细的调控。果蝇、斑马鱼、非洲爪蟾等物种的卵受精后,有些母源mRNA会被迅速脱腺苷酸化,导致翻译活性的抑制,随后可通过胞质多腺苷酸化(cytoplasmic polyadenylation)重新获得poly(A)尾[3-5]。有趣的是,通常脱腺苷酸化的mRNA很快会被降解[6],但在早期胚胎中却能保持数小时的稳定[7],其内在机理尚不清楚。
2022年12月7日,中国科学院大学杭州高等研究院、中国科学院分子细胞卓越创新中心朱学良课题组与中国科学院分子细胞卓越创新中心、广州国家实验室景乃禾课题组联合在国际学术期刊EMBO Journal杂志上发表了题为“Maternal mRNA deadenylation and allocation via Rbm14 condensates facilitate vertebrate blastula development”的研究论文,研究发现Rbm14和母源m6A-mRNA、脱腺苷酶Parn共同相分离形成的胞质凝聚体行使部分母源mRNA的脱腺苷酸化、储存及分配功能,从而促进脊椎动物囊胚期的正常进行。
该课题组之前的研究发现一个核定位的RNA结合蛋白Rbm14通过C端的内在无序区(Intrinsically Disordered Region, IDR)形成液态凝聚体,并调控了斑马鱼原肠胚时期背腹轴的形成[8]。由于Rbm14也是母源蛋白质因子,作者研究了它在斑马鱼早期胚胎中的定位,并惊讶地发现从4-细胞期(受精后1小时)至ZGA(1000-细胞期, 受精后3小时)之前Rbm14位于细胞质中并形成大量液态凝聚体,该凝聚体在有丝分裂期与中心体蛋白g-tubulin共同富集在纺锤体两极,并且在8-16细胞期沿着胚胎中线(Midline)呈不对称分布,说明它们可以被不均等地分配到子细胞中。随着ZGA启动该凝聚体逐渐消失,Rbm14也逐渐定位到细胞核内(图1)。
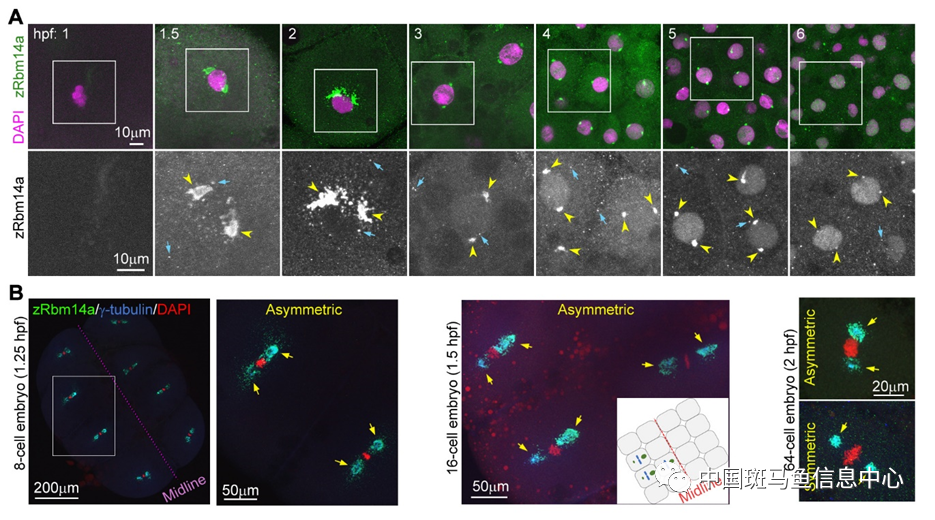

图1 斑马鱼早期胚胎发育中Rbm14的定位。A. 受精后1-6小时(hpf)胚胎分裂间期的细胞中Rbm14从胞质定位逐渐变为核定位。绿色标注Rbm14,紫色标注DNA(DAPI)。B. 有丝分裂期Rbm14凝聚体聚集在纺锤体两极呈不对称或对称分布,从左至右依次为:8-细胞期、16-细胞期、64-细胞期胚胎。绿色标注Rbm14,蓝色标注g-Tubulin,红色标注DNA(DAPI)。
核蛋白Rbm14在胞质形成凝聚体,是否由于其结合某些胞质因子?考虑到母源控制期的细胞质中存在大量母源mRNA,研究者首先采用RNA染料进行染色,结果表明Rbm14凝聚体内部富含母源RNA。文献报道斑马鱼的母源mRNA中存在N6-甲基腺苷(m6A)和5-甲基胞嘧啶(m5C)两种甲基化修饰,其中m6A修饰水平在受精后2小时(2hpf)达到最高之后逐渐降低,m5C水平继而逐渐升高[9, 10]。通过体外相分离实验,研究者分别证明了无甲基化修饰的RNA、m6A-RNA促进该凝聚体的形成并与Rbm14共同相分离,反之m5C修饰抑制该凝聚体的形成。
研究者进一步探索了Rbm14凝聚体的生理功能:斑马鱼和小鼠中Rbm14缺失的胚胎发育均停滞在囊胚期且胚胎致死,表明其对囊胚期发育的重要性;在斑马鱼胚胎中通过Rbm14敲低和挽救实验,证明了Rbm14的相分离和RNA结合对囊胚期发育是必需的。RNA深度测序结果表明Rbm14缺失的斑马鱼胚胎中有大量母源mRNA累积,体外poly(A)尾长测定实验证实了部分母源mRNA的poly(A)尾未被脱腺苷酸化。研究者进一步发现脱腺苷酸酶Parn与Rbm14相互作用并通过共同相分离促进Rbm14凝聚体形成。而且,Rbm14凝聚体中的Parn表现出很高的脱腺苷酸酶活性。
根据实验结果,研究者提出Rbm14凝聚体在时间-空间层面调控早期胚胎发育的分子机制模型(图2):Rbm14凝聚体通过Parn促进其中母源mRNA脱腺苷酸化,暂时储存脱腺苷酸后的mRNA以免其降解,并在有丝分裂期以对称或不对称的方式被分配到子代细胞中。随着发育进行,Parn水平降低,m5C修饰增加,Rbm14凝聚体逐渐解聚,释放无poly(A)尾的mRNA,使其可通过多腺苷酸化再次激活或被降解而清除,使细胞增殖、分化和母源-合子转换过程正常进行,从而促进囊胚向原肠胚的发育转变。
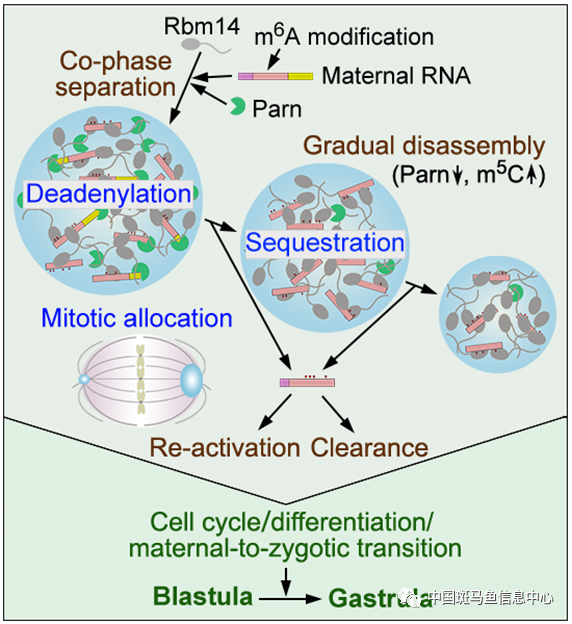
图2 Rbm14凝聚体调控早期胚胎发育的模式图

图2 Rbm14凝聚体调控早期胚胎发育的模式图
该研究揭示了Rbm14凝聚体在脊椎动物中通过协调mRNA的脱腺苷酸化、多腺苷酸化、m6A与m5C表观修饰等多个调控过程,动态又精细地调控了母源mRNA的翻译活性和稳定性。研究者推测,Rbm14凝聚体还可能通过在有丝分裂期将母源mRNA均等或差异地分配到子细胞中,从而调节细胞的增殖和命运。
杭州高等研究院博士后肖悦、分子细胞卓越创新中心博士生陈介会(现已毕业)为论文的共同第一作者。本研究得到了分子细胞卓越创新中心李劲松研究员、杨苏明博士、孙鸿华、谢乐乐的大力帮助,以及国家重点研发计划、中国科学院战略先导专项、国家自然科学基金、科技部浙江省博士后基金等资助。
参考文献
1. Marco, A., Clearance of Maternal RNAs: Not a Mummy's Embryo Anymore. Methods Mol Biol, 2017. 1605: p. 1-10.
2. Jukam, D., S.A.M. Shariati, and J.M. Skotheim, Zygotic Genome Activation in Vertebrates. Dev Cell, 2017. 42(4): p. 316-332.
3. Winata, C.L., et al., Cytoplasmic polyadenylation-mediated translational control of maternal mRNAs directs maternal-to-zygotic transition.Development, 2018. 145(1).
4. Salles, F.J., et al., Coordinate initiation of Drosophila development by regulated polyadenylation of maternal messenger RNAs.Science, 1994. 266(5193): p. 1996-9.
5. Kim, J.H. and J.D. Richter, Opposing polymerase-deadenylase activities regulate cytoplasmic polyadenylation. Molecular Cell, 2006. 24(2): p. 173-183.
6. Garneau, N.L., J. Wilusz, and C.J. Wilusz, The highways and byways of mRNA decay. Nat Rev Mol Cell Biol, 2007. 8(2): p. 113-26.
7. Vastenhouw, N.L., W.X. Cao, and H.D. Lipshitz, The maternal-to-zygotic transition revisited. Development, 2019. 146(11).
8. Xiao, Y., et al., Regulation of zebrafish dorsoventral patterning by phase separation of RNA-binding protein Rbm14. Cell Discov, 2019. 5: p. 37.
9. Zhao, B.S., et al.,m(6)A-dependent maternal mRNA clearance facilitates zebrafish maternal-to-zygotic transition. Nature, 2017. 542(7642): p. 475-478.
10. Yang, Y., et al., RNA 5-Methylcytosine Facilitates the Maternal-to-Zygotic Transition by Preventing Maternal mRNA Decay. Mol Cell, 2019. 75(6): p. 1188-1202 e11.