西南大学何建波组揭示肝脏重度损伤后启动再生的关键调控因子及其作用机制
作者:CZRC 发布时间:2023/1/16 15:56:37
肝脏拥有强大的再生能力,遭遇损伤后通常通过肝细胞快速增殖来完成肝脏再生。但在晚期重度肝硬化等肝脏遭受重度损伤的情况下,残留的肝细胞往往失去增殖能力而无法自我增殖。在重度损伤情况下肝脏的再生修复机制,直到2014年才由中国科学家率先发现并随后得到广泛证实[1,2]:此时,胆管细胞转分化成为新生肝细胞的主要细胞来源。在此转分化过程中,胆管细胞会首先去分化为双潜能细胞,然后再分化为肝细胞和胆管细胞来实现肝脏再生。因此,通过增加胆管细胞转分化来促进肝脏的原位快速再生,给晚期肝病患者的治疗带来了新的希望。但是到目前为止,虽然已发现胆管细胞去分化是由Dnmt1-mTORC1信号启动[3,4],但对于整个转分化过程的重要调控因子和作用机制还大量未知。
西南大学何建波课题组近期利用斑马鱼和小鼠肝脏损伤模型,发现Rngtt可以通过调控Dnmt1和mTORC1活性来促进胆管细胞转分化,进而启动肝脏再生。该研究于2023年1月3日以"Rngtt governs biliary-derived liver regeneration initiation by transcriptional regulation of mTORC1 and Dnmt1 in zebrafish"为题在线发表于国际知名期刊Hepatology上。


在该研究中,研究人员通过高通量正向遗传筛选获得肝脏再生突变体(lrd)。突变体早期肝脏发育正常,但肝脏重度受损后再生不能启动,通过基因定位克隆及条件性回补实验确定其致变基因为rngtt。研究发现,突变体胆管细胞向双潜能前体细胞的去分化过程受阻,随后双潜能细胞的增殖及再分化被抑制,最终导致在肝脏再生后期肝脏再生完全缺失。同时,抑制RNGTT的功能也能抑制小鼠肝脏损伤模型中胆管细胞的增殖,进一步证明了RNGTT在哺乳动物肝损伤中的功能保守性。为了深入揭示其调控胆管细胞去分化的分子机制,研究人员对受损肝脏组织中5’加帽mRNA进行免疫沉淀并分析差异基因表达,发现突变体受损肝脏中mTORC1信号通路的效应因子raptor、mtor及DNA甲基化调控因子dnmt1表达下调,进一步的抗体显色实验证明mTORC1信号及Dnmt1在突变体胆管细胞中的活性受到抑制。而通过在胆管细胞中条件性过表达Dnmt1能够部分回救rngtt突变引起的肝脏再生缺陷表型。
该工作结合斑马鱼和小鼠肝脏损伤模型,通过高通量正向遗传筛选鉴定调控胆管细胞的转分化的重要因子Rngtt;该研究证明了肝脏重度损伤后,Rngtt通过调控mTORC1信号效应因子及表观调控因子dnmt1的mRNA加帽并维持其在胆管中的高表达活性来参与肝脏再生起始。鉴于晚期肝病患者肝脏高度纤维化,肝细胞重度受损,残留肝细胞失去了自我增殖能力,因此加速胆管细胞向肝细胞的转分化具有重要意义。未来有望通过筛选小分子药物靶向激活Rngtt-Dnmt1-mTORC1 cascade来促进胆管细胞转分化,为晚期肝病的治疗提供了理论参考。
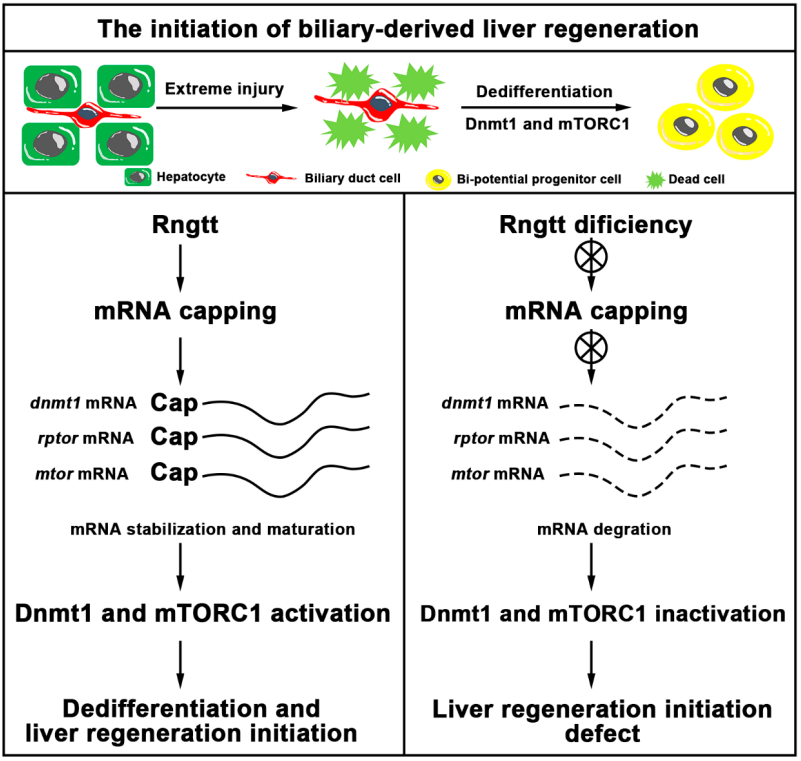
图1 工作原理图

图1 工作原理图
西南大学何建波教授为该论文通讯作者,博士后马建龙和博士研究生杨卓霖为论文共同第一作者。
参考文献:
1. He, J., Lu, H., Zou, Q., and Luo, L. (2014). Regeneration of liver after extreme hepatocyte loss occurs mainly via biliary transdifferentiation in zebrafish. Gastroenterology 146, 789-800.
2. Raven, A., Lu, W.Y., Man, T.Y., Ferreira-Gonzalez, S., O'Duibhir, E., Dwyer, B.J., Thomson, J.P., Meehan, R.R., Bogorad, R., Koteliansky, V., Kotelevtsev, Y., ffrench-Constant, C., Boulter, L., and Forbes, S. J. (2017). Cholangiocytes act as facultative liver stem cells during impaired hepatocyte regeneration. Nature 547, 350-354.
3. He, J., Chen, J., Wei, X., Leng, H., Mu, H., Cai, P., and Luo, L. (2019). Mammalian Target of Rapamycin Complex 1 Signaling Is Required for the Dedifferentiation From Biliary Cell to Bipotential Progenitor Cell in Zebrafish Liver Regeneration. Hepatology 70, 2092-2106.
4. He, J., Zhou, Y., Qian, C., Wang, D., Yang, Z., Huang, Z., Sun, J., Ni, R., Yang, Q., Chen, J., and Luo, L. (2022). DNA methylation maintenance at the p53 locus initiates biliary-mediated liver regeneration. NPJ Regenerative Medicine 7, 21.