天津医科大学郑祥建组/血液研究所王璐组合作揭示STK24/25抑制脑海绵状血管畸形的发生机制
作者:CZRC 发布时间:2023/2/9 4:00:00
脑海绵状血管畸形(Cerebral Cavernous Malformation,CCM)是一种发生在细小静脉的脑血管畸形,主要表现为出血,严重者并发中风和癫痫。该病由单层血管内皮细胞变薄,血管壁扩张并互相依附形成异常血管团引发,目前无药可治。研究表明CCM基因功能缺失性突变和编码MEKK3蛋白的MAP3K3基因功能获得性突变会引起脑海绵状血管畸形。CCM蛋白缺失会激活下游MEKK3-KLF2/4信号,但具体机制仍未知。
天津医科大学基础医学院郑祥建教授前期在斑马鱼和哺乳动物内皮细胞的工作中通过一系列生化和遗传分析实验发现STK24/25与CCM3互作参与CCM信号通路[1] ,但在哺乳动物中STK24/25的功能缺失是否能引起CCM疾病并不清楚。最近,郑祥建与中国医学科学院血液学研究所王璐等团队合作,在JCI Insight发表题为“Release of STK24/25 suppression on MEKK3 signaling in endothelial cells confers Cerebral cavernous malformation” 的研究论文。该研究利用基因工程小鼠,结合生化实验、micro-CT分析和斑马鱼模型,证明内皮细胞中敲除STK24/25会失去对MEKK3激酶活性的抑制功能进而造成血管畸变。


在发育过程中,内皮细胞特异性敲除STK24/25会造成小鼠脑血管布局紊乱,鳃弓动脉和背主动脉管腔发育受阻,不能形成正常血液循环,造成胚胎致死,该表型与CCM基因敲除后的表型一致。在小鼠出生后利用他莫昔芬在内皮细胞诱导敲除STK24/25产生比其他CCM基因敲除更为严重的CCM病变(图1)。
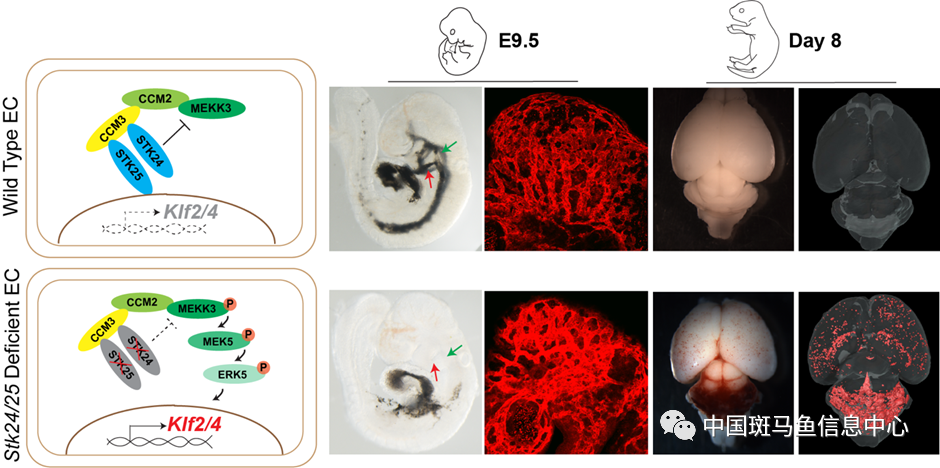
图1 Stk24/25缺失导致胚胎血管发育异常,不能形成完整血液循环。出生后诱导Stk24/25敲除使小鼠出现CCM病变。

图1 Stk24/25缺失导致胚胎血管发育异常,不能形成完整血液循环。出生后诱导Stk24/25敲除使小鼠出现CCM病变。
本研究构建了STK激酶结构域与CCM2蛋白中能够和MEKK3互作的结构域的融合蛋白,在分子水平证明了该融合蛋白能与MEKK3直接相互作用;斑马鱼模型的挽救实验证明STK-CCM2融合蛋白能够挽救ccm基因缺失造成的心脏扩张(图2),而不能与MEKK3直接结合的野生型STK25不具有此作用,说明在STK24/25通过参与CCM蛋白复合体负向调控MEKK3活性。
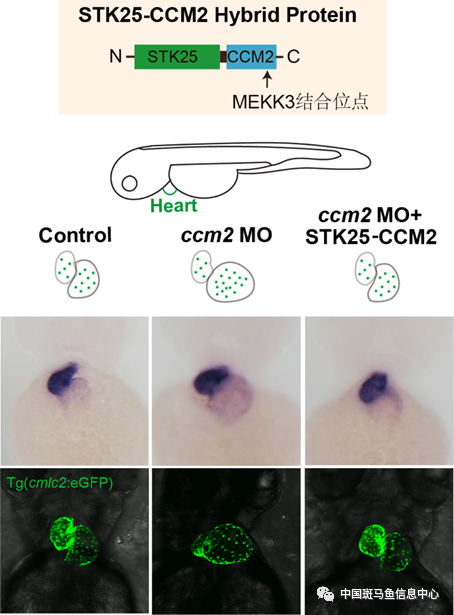
图2 STK-CCM2融合蛋白可以挽救ccm基因缺失造成的斑马鱼心脏扩张
综合以上内容,STK24/25与CCM蛋白相互作用形成复合物,共同对MEKK3信号通路发挥抑制作用,从而维持血管的正常发育和稳态。STK24/25缺失与CCM缺失相似,造成海绵状脑血管畸形。本研究初步解析了CCM蛋白缺失如何造成MEKK3激活,为MEKK3活性负向调控的研究提供了重要线索, 也为后续深入研究CCM疾病机制及下游治疗靶点提供新的思路。
天津医科大学基础医学院博士研究生杨希和武世婷为论文的共同第一作者。该研究得到国家自然科学基金和国家重点研发计划的资助。
参考文献:
1. Zheng X, Xu C, Di Lorenzo A, Kleaveland B, Zou Z, Seiler C, et al. CCM3 signaling through sterile 20-like kinases plays an essential role during zebrafish cardiovascular development and cerebral cavernous malformations. The Journal of clinical investigation.