西安电子科技大学陈雪利组实现斑马鱼显微结构及生化组分的三维全局可视化
作者:CZRC 发布时间:2023/4/6 9:25:00
三维显微容积成像技术可以实现样本的快速、全局定量成像,已被证明在脑功能、发育生物学和细胞代谢物的研究中具有重要的价值。当前,三维容积成像技术有多种,基于光学切片成像技术可以实现样本三维组织成像,例如,共聚焦或多光子显微镜可以识别样本的生化成分。但是,当成像尺寸超过几百微米时,成像非常耗时;基于光片成像技术可以克服成像耗时的影响,实现样本高分辨高速度三维容积成像,然而,该技术需要荧光标记,且随着样品表面与物镜距离的增加,图像质量往往会下降。投影断层成像技术可以克服图像质量退化的影响,通过旋转样本采集多角度投影图像实现样本的三维重建,例如光学投影断层成像技术(Optical projection tomography, OPT)可以实现样本的结构或组分成像,但基于激发式OPT成像技术需要荧光标记,由此会带来光漂白、光毒性等,不适用于检测生物的化学组分或者在体跟踪分子变化。
鉴于此,2023年3月24日,西安电子科技大学生命科学技术学院、西安市跨尺度生命信息智能感知与调控重点实验室生物医学光子学与分子影像研究室陈雪利教授团队在国际综合类顶级期刊Science Advances上发表了题为“Label-free structural and functional volumetric imaging by dual-modality optical-Raman projection tomography”的研究论文。该研究以斑马鱼为例,开发了一套光学-拉曼投影断层成像系统,可以实现样本结构以及生化组分的三维高分辨容积成像。


在该研究中,为了同机获取生物样本组织微结构及生化组分,研究人员搭建了一套ORPT成像系统(图1),系统采用“双激发源,单探测器”架构,在激发端,拉曼模态使用532 nm激发光经扩束优化后照射样本,通过旋转样本激发多角度拉曼投影信号,而光学模态则使用面光源直接照射样本。在探测端,使用同一CCD相机采集不同模态信号,为了实现对样本不同特征波段信号的采集,选用滤波轮实现不同波段滤光片的切换,同时使用长通滤光片滤除瑞利散射信号的影响。为了实现不同尺寸样本的高分辨成像,选用一可调放大镜头实现成像视野的灵活调节。
在系统空间分辨率实验中,以分辨率测试靶为标准样本,分别采集了不同放大倍数下测试靶图像,通过点扩散函数进行拟合分析,结果表明系统可实现5.12-36.42 μm的跨尺度样本分辨能力。以DMSO样本为研究对象进行了系统灵敏度测试,随着DMSO浓度的降低,拉曼信号以线性趋势下降,系统最低可实现70 mM分子信号的检测能力(图1D)。有研究表明,当成像系统激发端与探测端正交时,基于自发拉曼成像信号的激发功率与信号呈线性关系,对此结论进行了相关实验验证,结果与理论完全吻合(图1E)。图1F为数据采集及融合过程示意图。
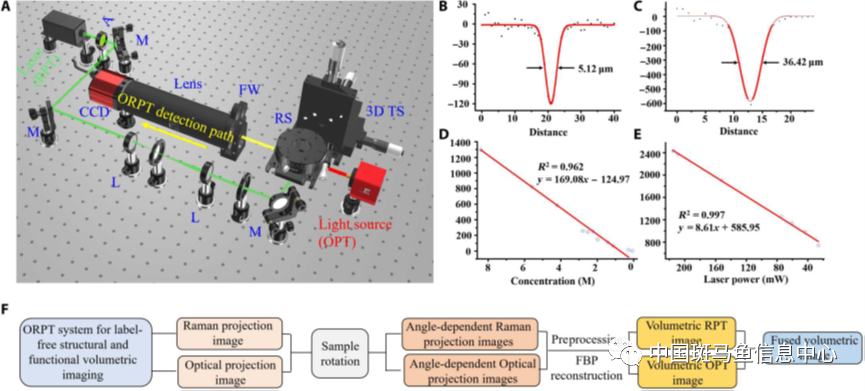
图1 ORPT系统成像示意图

图1 ORPT系统成像示意图
为了验证系统采集信号的能力,研究人员以斑马鱼为例,采集不同投影角度图像进行三维重建融合分析。在该实验中,选取斑马鱼拉曼高波数特征波段进行成像,通过FBP重建算法三维重建,进一步,通过3D Slicer进行校正融合,结果表明,斑马鱼微观结构与生化组分(2457-3123 cm-1)在位置上实现了很好地融合。在斑马鱼大囊泡周围具有明显的拉曼信号,代表其蛋白质组分和脂质组分分别在2950 cm-1、2850 cm-1处存在CH3以及C-H键的拉伸。此外,研究人员还发现在斑马鱼眼睛周围存在类似于拉曼的信号,为定性验证这一信号来源,研究人员分别探测不同特征波段信号(信号波段与非信号波段),发现信号强度存在较大差异,与其他文献报道具有一致结果。图2所示为斑马鱼的结构及相关生化组分的三维融合结果,在不同的视图(冠状面、矢状面、横切面)中,斑马鱼结构与生化组分可以很好融合可视化,由此证明了该技术对毫米尺度样本的微观结构和化学组分免标记三维高分辨率同机成像能力,这对于全面理解生物系统互作及变化等具有重要意义。
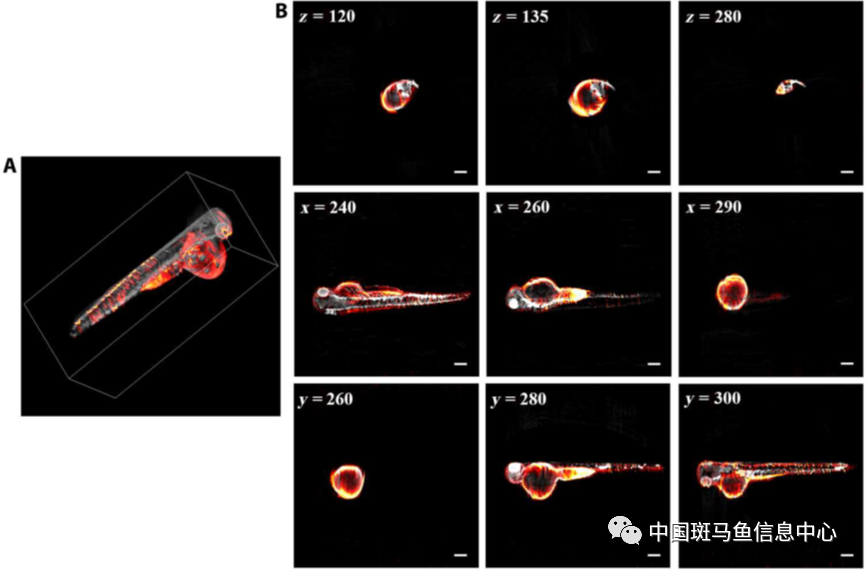
图2 斑马鱼三维容积成像
西安电子科技大学博士后王楠为论文第一作者,生命科学技术学院陈雪利教授、朱守平教授和谢晖教授为论文共同通讯作者。
参考文献:
1. K. Howe, M. D. Clark, C. F. Torroja, J. Torrance, C. Berthelot, M. Muffato, J. E. Collins, S. Humphray, K. McLaren, L. Matthews, The zebrafish reference genome sequence and its relationship to the human genome. Nature 496, 498–503 (2013).
2. M. Andreana, C. Sturtzel, C. P. Spielvogel, L. Papp, R. Leitgeb, W. Drexler, M. Distel, A. Unterhuber, Toward quantitative in vivo label-free tracking of lipid distribution in a zebrafish cancer model. Front. Cell Dev. Biol. 9, 746196 (2021).
3. H. Hogset, C. C. Horgan, J. P. K. Armstrong, M. S. Bergholt, V. Torraca, Q. Chen, T. J. Keane, L. Bugeon, M. J. Dallman, S. Mostowy, M. M. Stevens, In vivo biomolecular imaging of zebrafish embryos using confocal Raman spectroscopy. Nat. Commun. 11, 6172 (2020).
4. Z. L. Yu, T. Chen, X. N. Zhang, D. Fu, X. Liao, J. Shen, X. X. Liu, B. Zhang, X. S. Xie, X. D. Su, J. Y. Chen, Y. Y. Huang, Label-free chemical imaging in vivo: Three-dimensional non-invasive microscopic observation of amphioxus notochord through stimulated Raman scattering (SRS). Chem. Sci. 3, 2646–2654 (2012).
5. A. Akiva, G. Malkinson, A. Masic, M. Kerschnitzki, M. Bennet, P. Fratzl, L. Addadi, S. Weiner, K. Yaniv, On the pathway of mineral deposition in larval zebrafish caudal fin bone. Bone 75,192–200 (2015).
6. M. Bennet, A. Akiva, D. Faivre, G. Malkinson, K. Yaniv, S. Abdelilah-Seyfried, P. Fratal, A. Masic, Simultaneous Raman microspectroscopy and fluorescence imaging of bone mineralization in living zebrafish larvae. Biophys. J. 106, L17–L19 (2014).