刘峰组合作揭示异质性造血干细胞新起源
作者:CZRC 发布时间:2023/4/6 11:10:00
脊椎动物造血干细胞产生的场所是主动脉-性腺-中肾区,小鼠胚胎10.5天或斑马鱼胚胎受精28小时起,造血干细胞由动脉腹侧壁一群特化的内皮细胞,通过内皮-造血转化过程特化产生生血内皮细胞,随后出芽形成造血干细胞[1-6]。随着单细胞高通量测序技术的发展,多项研究表明胎儿造血干细胞存在异质性[7-9]。例如,利用谱系追踪小鼠胚胎期血细胞的发育,研究人员鉴定了胚胎期造血干细胞和造血祖细胞具有不同的谱系分化和终生造血潜能[10];转录因子Evi1的表达剂量参与调控胚胎期造血干细胞的命运决定[11];葡萄糖代谢激活炎性小体诱导干扰素il1b信号通路,抑制胚胎造血干细胞向红系偏好性造血干细胞特化,并促进淋/髓系偏好性造血干细胞的发育潜能[12];此外,MicroRNA-223介导的N-聚糖生物合成途径参与抑制淋/髓系偏好性造血干细胞的产生[9]。这些研究暗示造血干细胞的异质性可能早在其产生过程中已出现。然而,目前人们对于异质性造血干细胞在胚胎发生过程中的确切起源、分子特征和调控机制的认识尚不完善。
2023年4月4日,中国科学院动物研究所刘峰团队和中国医学科学院血液研究所王璐团队合作在Cell Research杂志发表题为“Activation of lineage competence in hemogenic endothelium precedes the formation of hematopoietic stem cell heterogeneity”的研究论文。该研究利用单细胞多组学、谱系追踪等技术,从单细胞和分子水平联合解析造血干细胞异质性起源及其分子机制。


首先,研究人员建立了斑马鱼胚胎期内皮-造血转化过程的单细胞转录组和染色质可接近性图谱并发现生血内皮细胞为异质性群体,与此同时,鉴定了生血内皮中决定异质性造血干细胞命运的关键调控因子spi2。随后,研究人员构建spi2转基因报告品系,通过单细胞高通量测序spi2阳性生血内皮深度揭示其淋/髓系谱系偏好的分子特征,谱系追踪实验进一步评估了其对胚胎期淋/髓系血细胞的贡献。细菌脂多糖处理显示spi2阳性淋/髓系偏好性生血内皮细胞在急性炎症情况下具有应激响应功能。此外,研究人员通过遗传操纵spi2表达水平能够改变体内的淋/髓偏好性造血干细胞的命运。进一步的机制解析发现,spi2通过直接抑制生血内皮细胞中内皮程序和促进关键造血谱系程序来控制淋/髓系偏好性造血干细胞的命运特化。最后,利用单细胞转录组解析,研究人员发现人体胚胎中存在保守的SPI1(哺乳动物中的spi2同源基因)阳性淋/髓系偏好的异质性生血内皮亚群,与此同时,借助人多能干细胞体外诱导血细胞的培养体系,进一步证实SPI1在人类血液产生中的保守作用。
综上所述,该研究揭示了造血干细胞异质性的谱系起源、生物学功能和分子调控机制,为研究体外诱导可移植的造血干细胞谱系新策略奠定了基础(图1)。
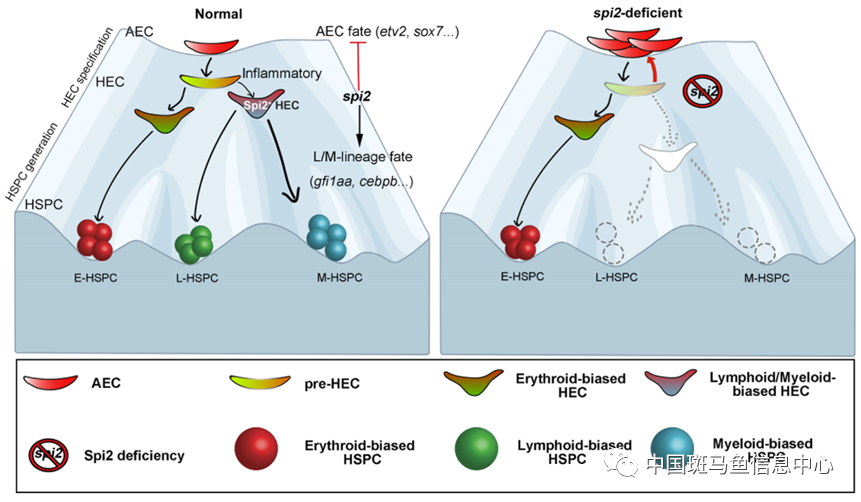
图1 异质性生血内皮细胞预先决定次级造血干细胞命运示意图
注:正常的发育过程中,内皮细胞特化成为具有特定谱系发育潜能的生血内皮细胞,预先决定了造血干细胞的异质性命运。其中,spi2标记的淋/髓系偏好性生血内皮细胞贡献产生淋/髓系偏好性造血干祖细胞;spi2缺失后,淋/髓系偏好性生血内皮细胞不能特化,退回为动脉内皮命运。

图1 异质性生血内皮细胞预先决定次级造血干细胞命运示意图
注:正常的发育过程中,内皮细胞特化成为具有特定谱系发育潜能的生血内皮细胞,预先决定了造血干细胞的异质性命运。其中,spi2标记的淋/髓系偏好性生血内皮细胞贡献产生淋/髓系偏好性造血干祖细胞;spi2缺失后,淋/髓系偏好性生血内皮细胞不能特化,退回为动脉内皮命运。
中国科学院动物研究所博士研究生夏均和中国医学科学院血液研究所刘梦瑶为本文共同第一作者,中国科学院动物研究所刘峰研究员和中国医学科学院血液研究所王璐研究员为本文共同通讯作者。该项目得到科技部国家重点研发计划、国家自然科学基金委重点项目和中科院先导专项的资助。
参考文献
1. Muller AM, Medvinsky A, Strouboulis J, Grosveld F, Dzierzak E. Development of hematopoietic stem cell activity in the mouse embryo. Immunity1994; 1:291-301.
2. Medvinsky A, Dzierzak E. Definitive hematopoiesis is autonomously initiated by the AGM region. Cell 1996; 86:897-906.
3. Boisset JC, van Cappellen W, Andrieu-Soler C, Galjart N, Dzierzak E, Robin C. In vivo imaging of haematopoietic cells emerging from the mouse aortic endothelium. Nature 2010; 464:116-120.
4. Perlin JR, Robertson AL, Zon LI. Efforts to enhance blood stem cell engraftment: Recent insights from zebrafish hematopoiesis. J Exp Med2017; 214:2817-2827.
5. Bertrand JY, Chi NC, Santoso B, Teng S, Stainier DY, Traver D. Haematopoietic stem cells derive directly from aortic endothelium during development. Nature2010; 464:108-111.
6. Kissa K, Herbomel P. Blood stem cells emerge from aortic endothelium by a novel type of cell transition. Nature 2010; 464:112-115.
7. Ganuza M, Hall T, Finkelstein D, Chabot A, Kang G, McKinney-Freeman S. Lifelong haematopoiesis is established by hundreds of precursors throughout mammalian ontogeny. Nat Cell Biol 2017; 19:1153-1163.
8. Porcheri C, Golan O, Calero-Nieto FJ et al. Notch ligand Dll4 impairs cell recruitment to aortic clusters and limits blood stem cell generation.EMBO J 2020; 39:e104270.
9. Kasper DM, Hintzen J, Wu Y et al. The N-glycome regulates the endothelial-to-hematopoietic transition. Science2020; 370:1186-1191.
10. Patel SH, Christodoulou C, Weinreb C et al. Lifelong multilineage contribution by embryonic-born blood progenitors. Nature 2022; 606:747-753.
11. Yokomizo T, Ideue T, Morino-Koga S et al. Independent origins of fetal liver haematopoietic stem and progenitor cells. Nature 2022; 609:779-784.
12. Frame JM, Kubaczka C, Long TL et al. Metabolic Regulation of Inflammasome Activity Controls Embryonic Hematopoietic Stem and Progenitor Cell Production. Dev Cell 2020; 55:133-149 e136.