杜久林团队发现突触发育的昼夜节律性
作者:CZRC 发布时间:2023/6/8 2:00:00
昼夜节律是生物体的一种计时现象,通常受到外界环境因素的影响,如光照和温度,并以24小时为周期进行振荡。在生理条件下,生物钟协调着神经、内分泌、心血管、免疫、代谢以及很多其他生物系统的功能[1-4]。但是,除了在诸如斑马鱼幼鱼的细胞周期[5,6]、果蝇的羽化[7],以及哺乳动物肾脏器官形成[8]中有少量报道外,人们对于生物钟是否以及如何调节生物体早期发育过程的认识及其匮乏。
2023年6月2日,中国科学院脑科学与智能技术卓越创新中心(神经科学研究所)、神经科学国家重点实验室杜久林团队在Nature Communications杂志在线发表题为“Circadian regulation of developmental synaptogenesis via the hypocretinergic system”的研究论文。该研究以斑马鱼经典的视网膜-视顶盖突触为模型,运用在体双光子长时程成像,探究突触发育的昼夜节律性及其调节机制。


本研究的研究人员在前期的工作中建立了特异标记视网膜-视顶盖突触的转基因斑马鱼模型[9],在本研究中则是利用该模型来探究突触发生是否具有昼夜节律性。首先,研究人员将出生后的斑马鱼幼鱼放在正常亮暗光照条件下,经过四天的训练或牵引(entrainment)后,开展以6小时为时间间隔、持续两天的长时程成像。分析发现突触数量的增长速率存在白天快、夜晚慢的昼夜振荡。这一振荡现象在亮暗光照牵引后转入持续亮或持续暗的光照条件,或者经过反向的暗亮光照条件牵引后都能保持,而在生物钟基因突变体(clocka-/-)中消失,提示这一振荡受到内源生物钟系统调节,具有昼夜节律性。进一步地,研究人员通过高时间分辨率成像分析突触发育的动态过程,发现这一节律是由突触形成(synapse formation)而非突触消除(synapse elimination)速率的昼夜差异造成的。接着,研究人员发现突触生长速率的节律性在下丘脑食欲素能(hypocretin/orexin)神经系统功能阻断后消失,提示该系统参与调节突触发育节律现象。最后,研究人员通过生物钟基因突变或食欲素能神经元受体突变破坏突触发生的节律性,发现可以造成视网膜神经节神经元轴突分枝变大、复杂度降低,突触数量减少、在轴突分枝区域中的密度降低和排布不均衡的结构变化;同时通过检测突触后视顶盖神经元的感受野,发现其感受野发生了与突触前神经元轴突分枝变大相呼应的增大现象,即其视锐度功能发育受到影响。
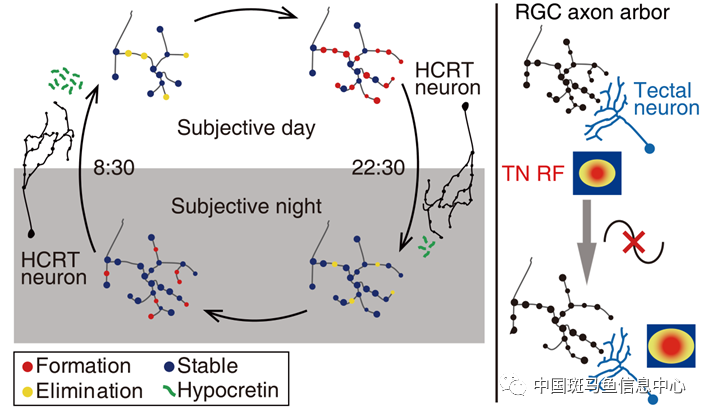
图1 发育早期突触发生的昼夜节律性的工作模型

图1 发育早期突触发生的昼夜节律性的工作模型
此研究工作一方面揭示了生物钟对生物体早期发育过程也具有调节作用,扩展了生物钟的功能谱;另一方面,揭示了神经系统环路发育过程中的一种新的调节机制。为生物钟参与调节动物发育过程提供了重要理论基础,也为认识神经环路联接建立的发育规律提供了重要实验依据。
该研究工作在杜久林研究员的指导下,主要由杜旭飞博士和李福宁博士共同完成;杜旭飞博士是该工作的共同通讯作者;彭小兰博士对本课题也做出了重要贡献。该研究工作得到了中国科学院脑科学与智能技术卓越创新中心严军研究组和苏州大学王晗研究组的大力帮助。该工作得到科技部、中科院的资助。
参考文献:
1. Musiek, E. S. & Holtzman, D. M. Mechanisms linking circadian clocks, sleep, and neurodegeneration. Science (80-. ). 354, 1004–1008 (2016).
2. Thosar, S. S. & Shea, S. A. Circadian control of human cardiovascular function. Curr. Opin. Pharmacol. 57, 89–97 (2021).
3. Scheiermann, C., Gibbs, J., Ince, L. & Loudon, A. Clocking in to immunity. Nat. Rev. Immunol. 18, 423–437 (2018).
4. Reinke, H. & Asher, G. Crosstalk between metabolism and circadian clocks. Nat. Rev. Mol. Cell Biol. 20, 227–241 (2019).
5. Dekens, M. P. et al. Light regulates the cell cycle in zebrafish. Curr Biol 13, 2051–2057 (2003).
6. Dickmeis, T. et al. Glucocorticoids play a key role in circadian cell cycle rhythms. PLoS Biol. 5, 854–864 (2007).
7. Myers, E. M., Yu, J. & Sehgal, A. Circadian Control of Eclosion: Interaction between a Central and Peripheral Clock in Drosophila melanogaster. Curr. Biol. 13, 526–533 (2003).
8. Dan, H., Ruan, T. & Sampogna, R. V. Circadian Clock Regulation of Developmental Time in the Kidney. Cell Rep. 31, 107661 (2020).
9. Du, X. fei, Xu, B., Zhang, Y., Chen, M. jia & Du, J. lin. A transgenic zebrafish model for in vivo long-term imaging of retinotectal synaptogenesis. Sci. Rep. 8, 1–11 (2018).