徐鹏飞和白戈团队合作发现Follistatin在脊椎动物左右不对称建立过程中的时空屏障作用
作者:CZRC 发布时间:2023/6/8 2:43:00
脊椎动物胚胎从一个受精卵如何逐步形成具有前后、背腹和左右等不对称性特征的生命体,是发育生物学领域由来已久的谜题。其中左右轴作为最后确定的体轴。动物的左右不对称性在自然界中普遍存在,例如招潮蟹的钳子呈现一大一小的差异,蜗牛壳的右旋比例远高于左旋,比目鱼的双眼分布在同一侧以及大部分脊椎动物在对称的外形下潜藏了左右不对称的内脏器官。正确的左右模式对胚胎发育至关重要,这些模式在人体发育过程中一旦发生异常,可能会导致疾病的发生。例如,部分人群内脏器官的左右定位与正常人不同,正常在左侧的器官会出现在右侧或中间,反之亦然,医学上称其为异位症(Heterotaxy)。异位症是一种遗传性疾病,在人群中出现的概率约为1/10000 [1]。值得注意的是,在异位症患者中,先天性心脏病(Congenital heart disease, CHD)的发病率显著提高,最为常见的症状主要为大动脉转位和室间隔缺损 [2]。异位症患者也可能出现心外畸形,包括多脾脏(多脾症)、中位肝脏和肝外胆道闭锁等。
目前认为,脊椎动物左右不对称的建立主要分为三个过程:左右对称性的打破,不对称信号的激活和传递,器官的定位应答。位于胚胎末端的左右组织者(Left-Right Organizer, LRO)以纤毛依赖或非依赖的方式打破两侧的对称性,导致其下游相关信号(Ca2+等)的不对称响应,进而促进Nodal信号在侧板中胚层(Lateral Plate Mesoderm, LPM) 中的不对称表达。在位于胚胎正中的中线屏障作用下,Nodal信号随后在左侧LPM中从后向前(posterior to anterior,PA)传播,逐步引导来自三个胚层的组织和器官的左右不对称定位,如心脏(中胚层)、肝脏/胰腺/肠道(内胚层)和前脑(神经外胚层)[3]。因此,Nodal信号在前后方向上传播的时空准确性对胚胎左右模式的建立有重要作用,特别是对位于胚胎最前端的脑[4, 5]。然而,调节Nodal信号的传播以确保其在前后方向上正确行使功能的机制知之甚少。
此外,脑的左右模式的正确形成对其解剖结构和功能起着重要作用。在斑马鱼中,前脑中左侧Nodal信号的不对称表达依赖于左侧LPM的Spaw(斑马鱼中Nodal的同源性配体)[6]。然而,一些研究表明,LPM中Spaw和前脑Nodal信号的不对称表达存在不耦合的现象[5, 7],该现象困惑领域很久。
2023年6月5日,浙江大学医学院徐鹏飞与白戈团队合作,在PNAS上发表题为“A spatiotemporal barrier formed by Follistatin is required for left–right patterning”的研究论文,该论文首次阐明了Follistatin调控Nodal信号从胚胎后部往前部方向传播的具体机制,同时发现了其调节斑马鱼中前脑不对称建立的信号及其具体机制。


Follistatin是TGF-β超家族的成员,通过抑制其他TGF-β家族成员的活性(包括Activin、BMP和Myostatin),在许多发育和疾病过程中发挥重要作用。徐鹏飞团队之前的研究中发现斑马鱼中Follistatin的同源基因fsta可能是Nodal信号通路的下游基因[8],在该研究中通过敲低或过表达nodal信号来影响fsta的表达验证了这一假设。
该研究发现Fst通过直接结合Spaw和竞争性阻断其与受体的相互作用来抑制Spaw在胚胎两侧LPM从后往前的传播。Fst功能缺失会导致斑马鱼中spaw在LPM中双侧表达和lefty1在前脑中过早以及双侧表达,进而导致斑马鱼神经系统左右不对称定位的异常。同时,该研究发现斑马鱼前脑左右不对称信号的建立依赖于Fst对Activin-Ndr2-Lefty1的抑制作用。该研究首次发现Activin是斑马鱼上丘脑Nodal信号激活和传导所必需的,但是这种激活被由早期Nodal信号激活的Fst所抑制,之后来自LPM的Spaw在后期克服了Fst的抑制,激活前脑中左侧特异Nodal信号(ndr2/lefty1)的表达。前脑中这种由Fsta、Activin和Nodal信号构成的共同协调机制,提供了一个迅速响应来自LPM传递的Nodal信号的保障,以确保斑马鱼前脑中Nodal信号表达的时空正确性。
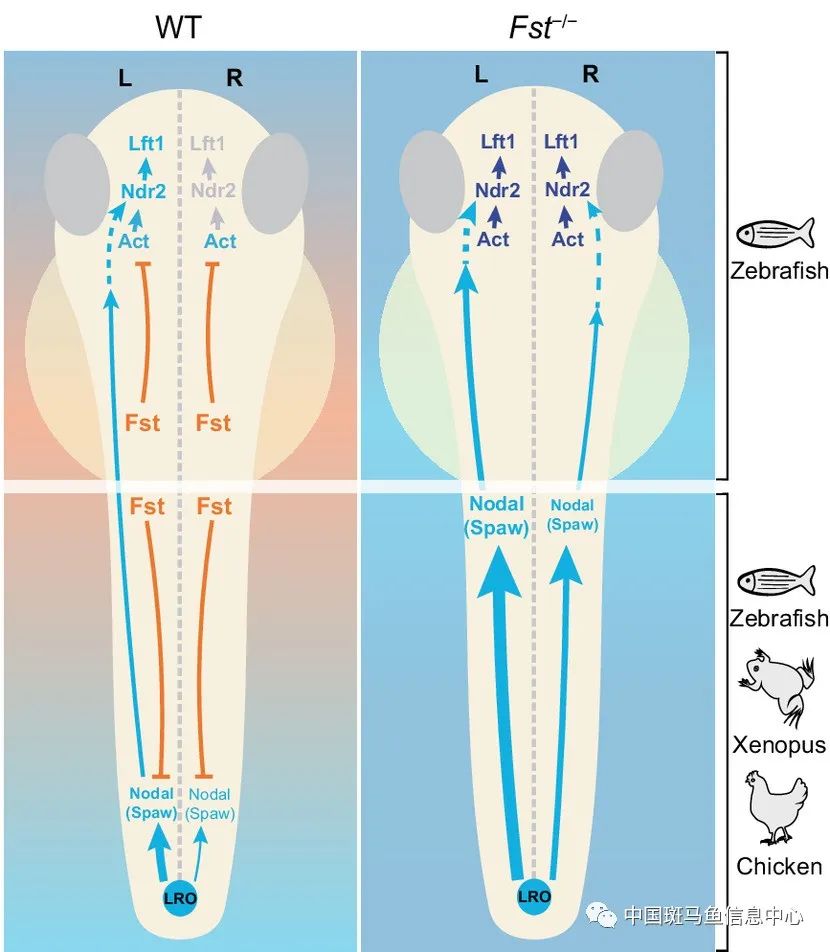
图1 工作模型图

图1 工作模型图
浙江大学医学院徐鹏飞和白戈研究员为本文的共同通讯作者,浙江大学医学院符欣欣、卓定浩、张颖洁和李云飞为论文的共同第一作者。该研究得到了弗吉尼亚大学Bernard Thisse教授和Christine Thisse教授,浙江大学杨小杭教授和管敏鑫教授,清华大学孟安明院士,北京科技大学幸岑璨研究员和同济大学林古法教授的大力支持。
参考文献:
1. Shiraishi I, Ichikawa H. Human Heterotaxy Syndrome [J]. Circulation Journal, 2012, 76(9): 2066-2075.Circulation Journal 76, 2066-2075 (2012).
2. M. P. Kennedy et al., Congenital Heart Disease and Other Heterotaxic Defects in a Large Cohort of Patients With Primary Ciliary Dyskinesia. Circulation 115, 2814-2821 (2007).
3. D. T. Grimes, R. D. Burdine, Left-Right Patterning: Breaking Symmetry to Asymmetric Morphogenesis. Trends Genet 33, 616-628 (2017).
4. X. Wang, H. J. Yost, Initiation and propagation of posterior to anterior (PA) waves in zebrafish left-right development. Dev Dyn237, 3640-3647 (2008).
5. R. D. B. Miguel L Concha, Claire Russell, Alexander F Schier, Stephen W Wilson, A nodal signaling pathway regulates the laterality of neuroanatomical asymmetries in the zebrafish forebrain. Neuron 28, 399-409 (2000).
6. S. Long, N. Ahmad, M. Rebagliati, The zebrafish nodal-related gene southpaw is required for visceral and diencephalic left-right asymmetry. Development 130, 2303-2316 (2003).
7. A. Inbal, S. H. Kim, J. Shin, L. Solnica-Krezel, Six3 represses nodal activity to establish early brain asymmetry in zebrafish. Neuron55, 407-415 (2007).
8. T. Cheng et al., Nodal coordinates the anterior-posterior patterning of germ layers and induces head formation in zebrafish explants. Cell Reports 42, 112351 (2023).