浙江大学刘广绪团队发现TCEP通过扰乱斑马鱼下丘脑-垂体-甲状腺轴和肠-肝轴诱导肝脏毒性
作者:CZRC 发布时间:2023/6/19 10:00:00
有机磷酸酯(OPEs)作为阻燃剂和增塑剂广泛应用于各种消费品中。由于大量的生产和使用,OPEs不可避免地进入到环境中,已成为一个重要的新兴环境问题。三磷酸(2-氯乙基)酯(TCEP)是经常检测到的具有代表性的OPEs之一。最近有研究表明TCEP可能对淡水鱼(Cirrhinus mrigala)具有肝毒性,但这种影响是否在鱼类物种中普遍存在以及其潜在的毒性作用机制尚不明晰。
2023年6月5日,浙江大学动物科学学院刘广绪教授和特聘副研究员施巍博士合作在环境领域知名期刊Environmental Science & Technology上发表了题为“Tris(2-chloroethyl) Phosphate Exerts Hepatotoxic Impacts on Zebrafish by Disrupting Hypothalamic-Pituitary-Thyroid and Gut-Liver Axes”的研究论文,该研究发现TCEP可能通过干扰HPT轴和肠-肝轴引起肝脏氧化应激和炎症,进而对斑马鱼产生肝毒性作用。


该研究通过对斑马鱼进行28天环境浓度水平(0.5和5.0 μg/L)的TCEP暴露,探究了TCEP对斑马鱼肝脏健康的影响及其作用机制。研究结果表明,TCEP暴露会导致肝损伤特异性标志物谷草转氨酶(AST)、丙氨酸转氨酶(ALT)和碱性磷酸酶(ALP)显著改变,引发斑马鱼肝组织病变。
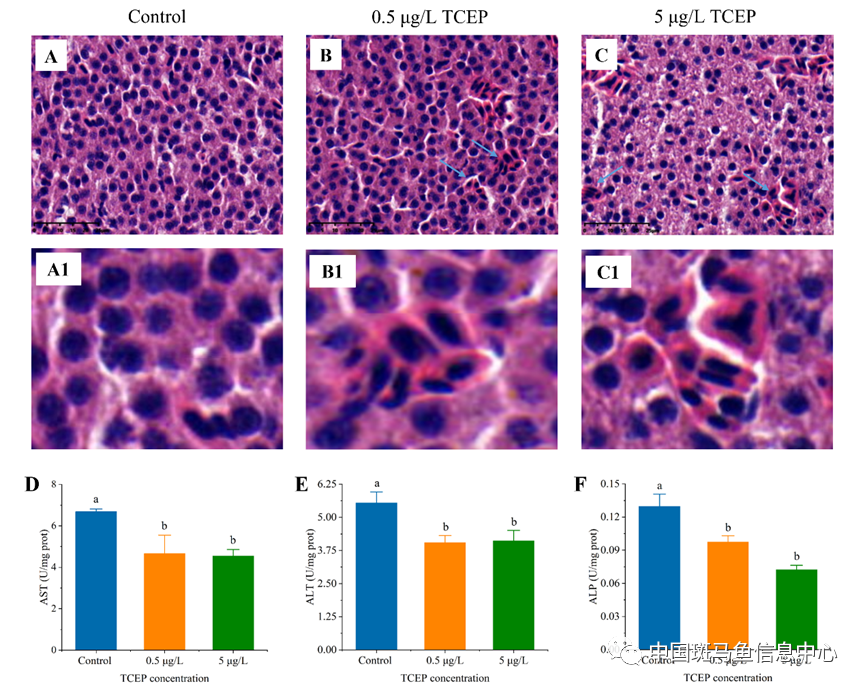
图1 在对照及低浓度(0.5 μg/L)和高浓度(5 μg/L)TCEP处理28天后,斑马鱼肝脏HE切片(A-C)及组织病变部分放大图(A1-C1),以及肝脏AST(D)、ALT(E)和ALP(F)酶活性。

图1 在对照及低浓度(0.5 μg/L)和高浓度(5 μg/L)TCEP处理28天后,斑马鱼肝脏HE切片(A-C)及组织病变部分放大图(A1-C1),以及肝脏AST(D)、ALT(E)和ALP(F)酶活性。
此外,TCEP暴露显著改变了斑马鱼HPT轴激素水平,使其大脑中促甲状腺素释放激素(TRH)和促甲状腺激素(TSH)水平降低,同时血浆中甲状腺素(T4)含量增加,而三碘甲状腺原氨酸(T3)含量减少,并显著干扰了大脑和肝脏中HPT轴相关基因的表达。
为期28天的TCEP暴露还导致斑马鱼肠道菌群中拟杆菌门(Bacteroidota)的比例增加,血浆中细菌脂多糖(LPS)含量升高,肝脏中LPS结合蛋白和toll样受体4的表达上调,进而激活了下游炎症通路,使肝脏中炎症因子白细胞介素(IL)-6、IL-1β和肿瘤坏死因子(TNF-α)水平显著升高。
此外,TCEP暴露还干扰了斑马鱼抗氧化系统,使谷胱甘肽(GSH)含量及超氧化物歧化酶(SOD)活性降低,活性氧(ROS)在肝脏累积并引起脂质过氧化(丙二醛MDA含量显著升高),导致斑马鱼肝脏发生氧化损伤。
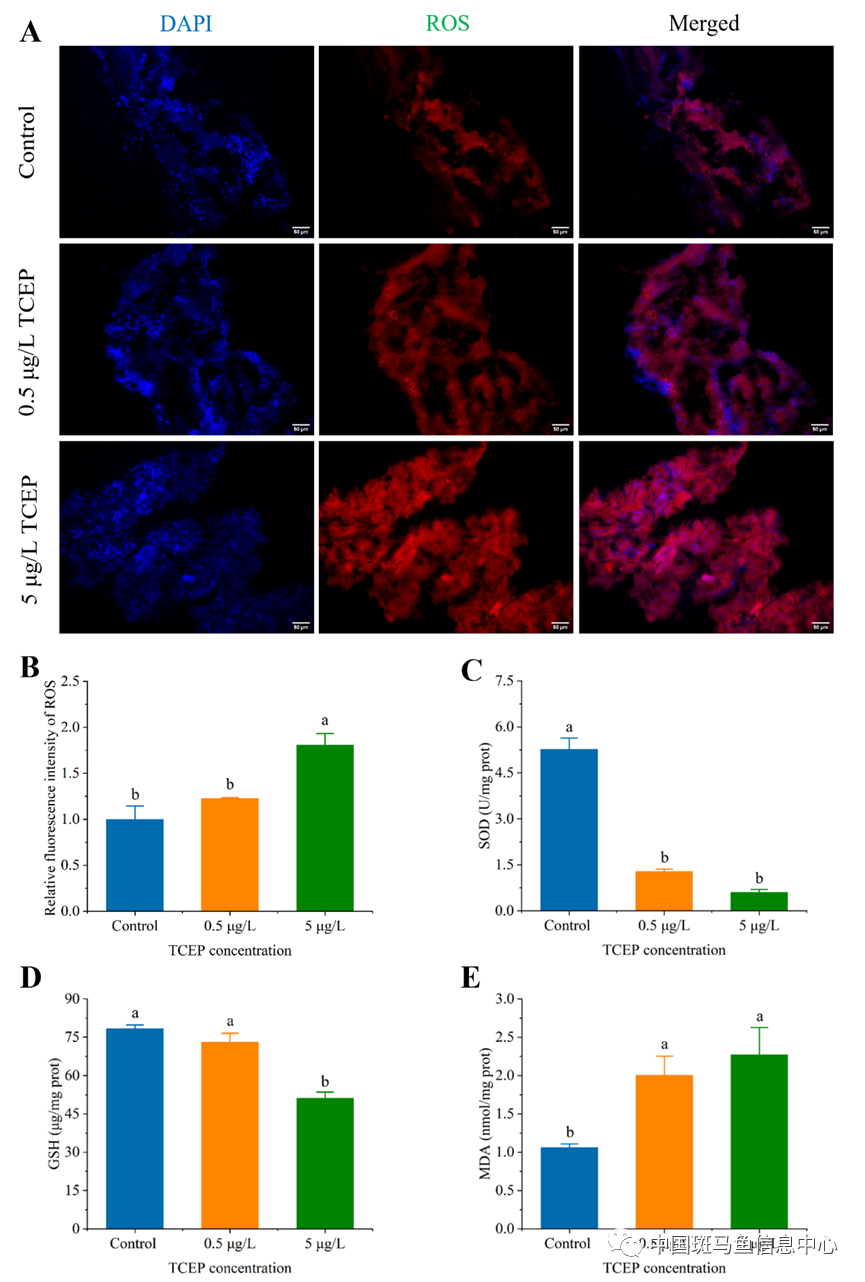
图2 在对照及低浓度(0.5 μg/L)和高浓度(5 μg/L)TCEP处理28天后,斑马鱼肝脏ROS特异性荧光染色(A),ROS相对荧光强度(B;n = 3),肝脏SOD酶活性(C;n = 6),GSH含量(D;n = 6),以及MDA含量(E;n = 6)。

图2 在对照及低浓度(0.5 μg/L)和高浓度(5 μg/L)TCEP处理28天后,斑马鱼肝脏ROS特异性荧光染色(A),ROS相对荧光强度(B;n = 3),肝脏SOD酶活性(C;n = 6),GSH含量(D;n = 6),以及MDA含量(E;n = 6)。
综上所述,我们的研究结果表明,环境现实水平的TCEP可以通过扰乱斑马鱼HPT轴和肠-肝轴诱导肝毒性(图3)。由于斑马鱼与包括人类在内的其他脊椎动物具有高度的同源性,因此TCEP在环境中的残留值得进一步关注。
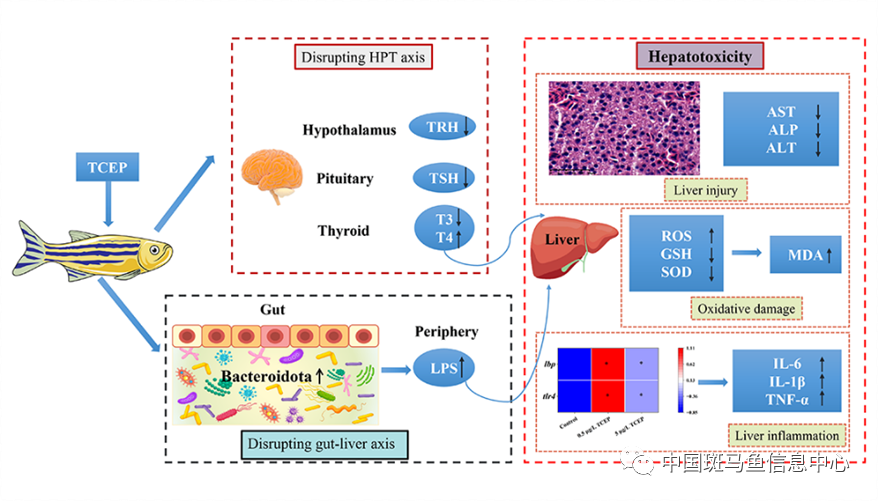
图3 TCEP通过扰乱斑马鱼下丘脑-垂体-甲状腺轴和肠-肝轴诱导肝脏毒性

图3 TCEP通过扰乱斑马鱼下丘脑-垂体-甲状腺轴和肠-肝轴诱导肝脏毒性
浙江大学研究生田丹丹为论文第一作者,浙江大学刘广绪教授和特聘副研究员施巍博士为该论文的共同通讯作者。