美国科学家揭示黑色素瘤-角质细胞间的GABA信号传导可促进肿瘤发生
作者:CZRC 发布时间:2023/8/29 10:45:00
黑色素瘤发生于真皮-表皮交界处,通常存在BRAF或NRAS等基因突变,然而,这些突变也会发生在良性痣中,为什么有些会发展成黑色素瘤而有些不能?皮肤黑色素细胞被包裹在致密的微环境细胞网络中,大部分为角质细胞,而人们对于这些细胞是否在黑色素瘤发生中发挥作用仍不清楚。
为了解决这一问题,来自纪念斯隆·凯特琳癌症中心的Richard M. White团队在Cancer Discovery杂志上发表了一篇题为“GABA regulates electrical activity and tumor initiation in melanoma”的文章,他们证明角质细胞和黑色素细胞间的GABA信号传导可促进BRAFV600E黑色素瘤发生,黑色素瘤细胞中GABA合成的遗传和药理学干扰可抑制体内黑色素瘤发生,表明皮肤微环境中的GABA信号传导调节癌基因以触发黑色素瘤的能力。


研究发现角质细胞在黑色素瘤中同时具有促肿瘤和抗肿瘤发生的作用[1, 2],且黑色素细胞会向外输出含RNA和蛋白质的外泌体[3],为了证明黑色素瘤细胞和角质细胞之间存在通讯,研究者利用人和小鼠的上述两种细胞构建一个报告系统,原理为在黑色素细胞特异性mitfa启动子下表达Cre,在角质细胞特异性krt4启动子下表达floxed lacZ GFP-RFP报告基因,因而任何从黑色素细胞吸收含Cre囊泡的角质细胞都会表达RFP荧光,观察结果证实了细胞间通讯的存在,作者进而利用已建立的硝酸还原酶介导的角质细胞特异性消融策略[4]证明黑色素瘤的发生依赖于这种通讯。
然而,调节这种黑色素/角质细胞串扰的机制尚不清楚。为此,研究者利用表达Cre的人A375黑色素瘤细胞和表达floxed dsRED-GFP报告基因的角质细胞,以及含一系列影响明确生物学途径的LOPAC1280文库进行小分子筛选,结果显示前10个命中中有3个与GABA信号传导有关。对经历Cre介导的转换角质细胞进行RNA-seq,发现与化学筛选结果一致,GABA-A受体激活相关途径显著富集,不仅如此,与突触形成相关途径也明显富集。随后,作者通过电镜和电生理证实了两种细胞间确实存在抑制性电化学细胞-细胞连接,如果在角质细胞中过表达GABA-A受体亚基的失活形式以破坏这种通讯,则会抑制斑马鱼体内黑色素瘤产生。
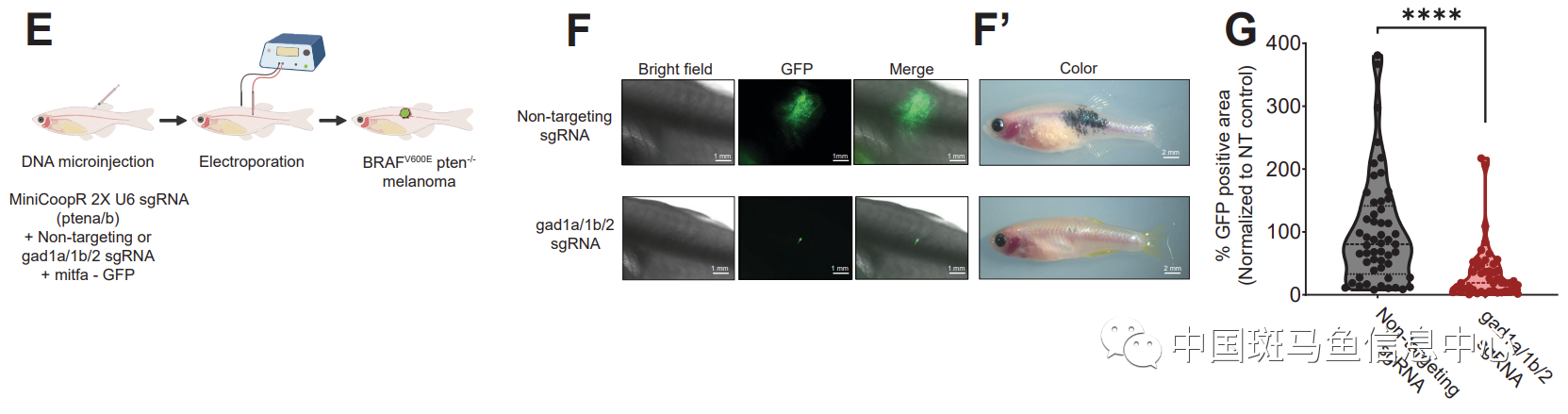
图1 破坏GABA信号可以抑制斑马鱼黑色素瘤的形成

图1 破坏GABA信号可以抑制斑马鱼黑色素瘤的形成
为了确认GABA在角质细胞中如何促进黑色素瘤发生,作者将黑色素瘤细胞与未接受或接受黑色素瘤细胞信号的角质细胞共培养,发现后者组中黑色素瘤细胞增殖速度显著增加,对比两种角质细胞的RNA-seq结果发现几个已知会促黑色素瘤发生的基因FGF5、BMP6和LIF表达显著升高。于是作者测试抑制这些途径是否会减缓黑色素瘤细胞增殖,但仅LIF受体抑制显示出明显效果,此外,用siRNA靶向黑色素瘤细胞中的LIFR也能减少其增殖。这些发现表明GABA-A受体阳性角质细胞通过将LIF分泌到黑色素瘤微环境中来介导其促肿瘤作用,从而增加黑色素瘤细胞的增殖。
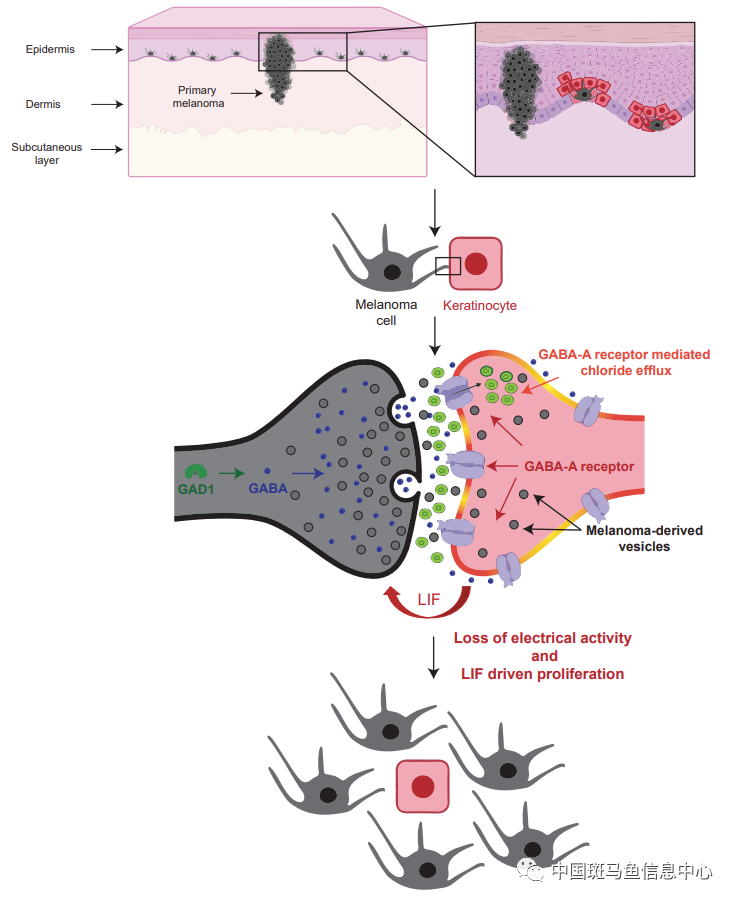
图2 GABA能信号驱动的黑色素瘤-角质细胞通讯模型

图2 GABA能信号驱动的黑色素瘤-角质细胞通讯模型
综上所述,这项工作确定了黑色素瘤微环境中黑色素瘤细胞和角质细胞间的一种新的通讯模式——GABA能抑制性电化学细胞-细胞连接,这种GABA能抑制性信号的激活可通过促肿瘤因子的分泌促进黑色素瘤细胞的增殖,提示破坏这种细胞间通讯可作为黑色素瘤的潜在治疗靶点。
参考文献:
1. Chung H, Suh E-K, Han I-O, Oh E-S. Keratinocyte-derived laminin-332 promotes adhesion and migration in melanocytes and melanoma. J Biol Chem. 2011;286:13438–47.
2. Ableser MJ, Penuela S, Lee J, Shao Q, Laird DW. Connexin43 reduces melanoma growth within a keratinocyte microenvironment and during tumorigenesis in vivo. J Biol Chem. 2014;289:1592–603.
3. W?ster P, Eriksson I, Vainikka L, Rosdahl I, ?llinger K. Extracellular vesicles are transferred from melanocytes to keratinocytes after UVA irradiation. Sci Rep. 2016;6:27890.
4. Sharrock AV, Mulligan TS, Hall KR, Williams EM, White DT, Zhang L, et al. NTR 2.0: a rationally engineered prodrug-converting enzyme with substantially enhanced efficacy for targeted cell ablation. Nat Methods. 2022;19:205–15.