华南理工张文清/黄志斌团队与广药大沈娟团队合作揭示滥用抗炎药舒林酸引起行为活跃
作者:CZRC 发布时间:2023/9/8 10:30:00
非甾体抗炎药物(NSAIDs)是使用最广泛的药物之一,每天有超过3000万患者使用,具有镇痛、抗炎、抗风湿和退热作用,主要应用于慢性疼痛、发热和类风湿关节炎等疾病的治疗。这类药物包括阿司匹林、布洛芬、对乙酰氨基酚和舒林酸(sulindac)等,因其疗效确切、价格低廉,且使用方便,广受患者欢迎。特别是近年,全球COVID-19感染者数量爆发式增长,不少患者大量囤积和使用NSAIDs药物,引发了对于NSAIDs滥用、超剂量使用和副作用增加等问题的担忧,特别是对于孕妇和儿童长期服用NSAIDs所存在风险的担忧。
据美国FDA统计,约1/3的药物不良反应与NSAIDs有关,每年有大约41,000名老年患者因NSAIDs住院治疗,3,300人因此丧生。长期使用NSAIDs可导致多器官副作用。然而,NSAIDs在神经系统中的作用目前仍存在争议。有报道提示大剂量使用非甾体抗炎药可能增加患阿尔茨海默症风险,也有研究者提出NSAIDs可以减轻神经系统的炎性反应,如甲那芬酸对小鼠具有神经保护作用,改善认知。因此,应用一种便捷的方法来评估NSAIDs对神经系统的作用,特别是其在神经发育过程中的作用,并深入探讨作用机制,将有助于临床医生更合理地选择并应用这些药物。
2023年9月2日,华南理工大学医学院张文清/黄志斌团队与广东药科大学的沈娟团队合作,在知名学术期刊Nature Communications上发表了题为“Sulindac selectively induces autophagic apoptosis of GABAergic neurons and alters motor behavior in zebrafish”的文章,该研究深入探讨了过量使用舒林酸(sulindac)在幼年动物早期神经发育中选择性诱导GABA能神经元凋亡的作用,这一发现提示我们需要关注孕妇和婴幼儿在服用舒林酸时的潜在风险。


斑马鱼繁殖快,体积小、体透明,与人类基因组的相似度高达87%,也与人类有近似的毒性特征和信号传导通路,对于药物的高通量筛选和安全性评价具有独特优势。研究人员采用斑马鱼幼鱼作为模型生物,对临床上常用的NSAIDs进行了逐一筛选和评估。令人惊讶的是,研究者们发现sulindac,一种广泛用于骨关节炎和类风湿性关节炎等疾病治疗的非选择性COXs抗炎药,引起斑马鱼幼鱼脑神经元的大量凋亡。
有趣的是,这些凋亡细胞特异性地分布在中脑,而在躯干部位未观察到明显的凋亡细胞。为了进一步探讨sulindac对哪些神经元有影响,研究人员使用了不同类型的斑马鱼神经元转基因品系。结果发现凋亡细胞与Tg(gad1b:mCherry)标记的GABA能神经元共定位(图1a,b),而不与Tg(vglut2a:GFP)标记的谷氨酸能神经元、Tg(islet:GFP)标记的颅运动神经元或Tg(atoh7:mCherry)标记的视网膜神经节细胞共定位。GABA能神经元是脊椎动物大脑中的抑制性神经元,也是GABA神经递质的主要来源。这些神经元在多个神经环路和神经精神疾病中发挥着重要作用,如狂躁情绪、惊恐障碍、自闭障碍、精神分裂症和失眠行为障碍等。研究人员于是使用光周期刺激试验来监测5 dpf时幼鱼的行为轨迹(图1c-g)。与对照组相比,暴露于sulindac的斑马鱼表现出过度活跃的行为,而且与剂量相关。
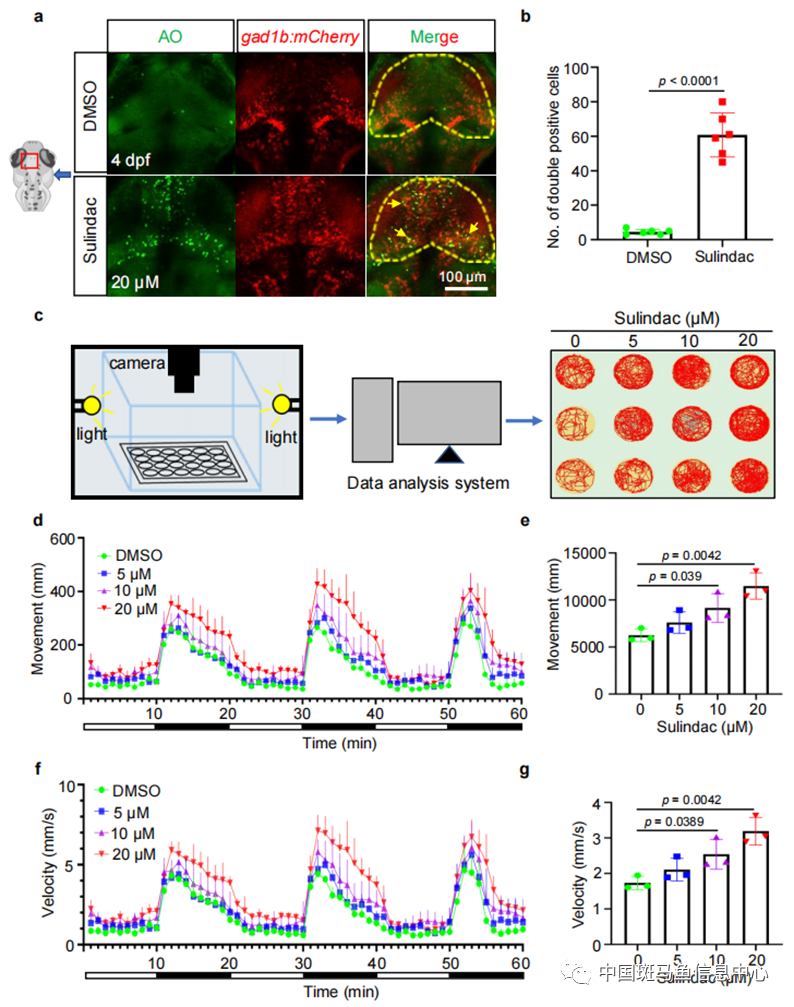
图1 Sulindac选择性诱导斑马鱼GABA能神经元凋亡和运动行为改变

图1 Sulindac选择性诱导斑马鱼GABA能神经元凋亡和运动行为改变
为了进一步揭示sulindac选择性诱导斑马鱼GABA能神经元凋亡的机制,作者通过斑马鱼幼鱼全脑的10ⅹ单细胞RNAseq分析发现,在GABA能神经元亚群中,只有akt1特异性表达,而不是akt2和akt3(图2a, b)。尽管akt1的表达并未在多数细胞中检测到,但足以提供潜在机制的线索。通过免疫荧光共定位试验进一步确认,在3 dpf斑马鱼中脑区域,GABA 神经元特异表达akt1。为了进一步支持这一观点,作者在GABA能神经元中进行了组织特异性敲除akt1或过表达akt1。GABA神经元特异性敲除akt1后可以模拟sulindac引起的GABA能神经元凋亡的表型,而Akt1激动剂和外源性akt1 mRNA处理可以有效地逆转sulindac引起的GABA能神经元凋亡现象。这些数据支持了sulindac诱导GABA能神经元凋亡这一过程可能通过GABA能神经元中特异性表达的Akt1蛋白的介导。
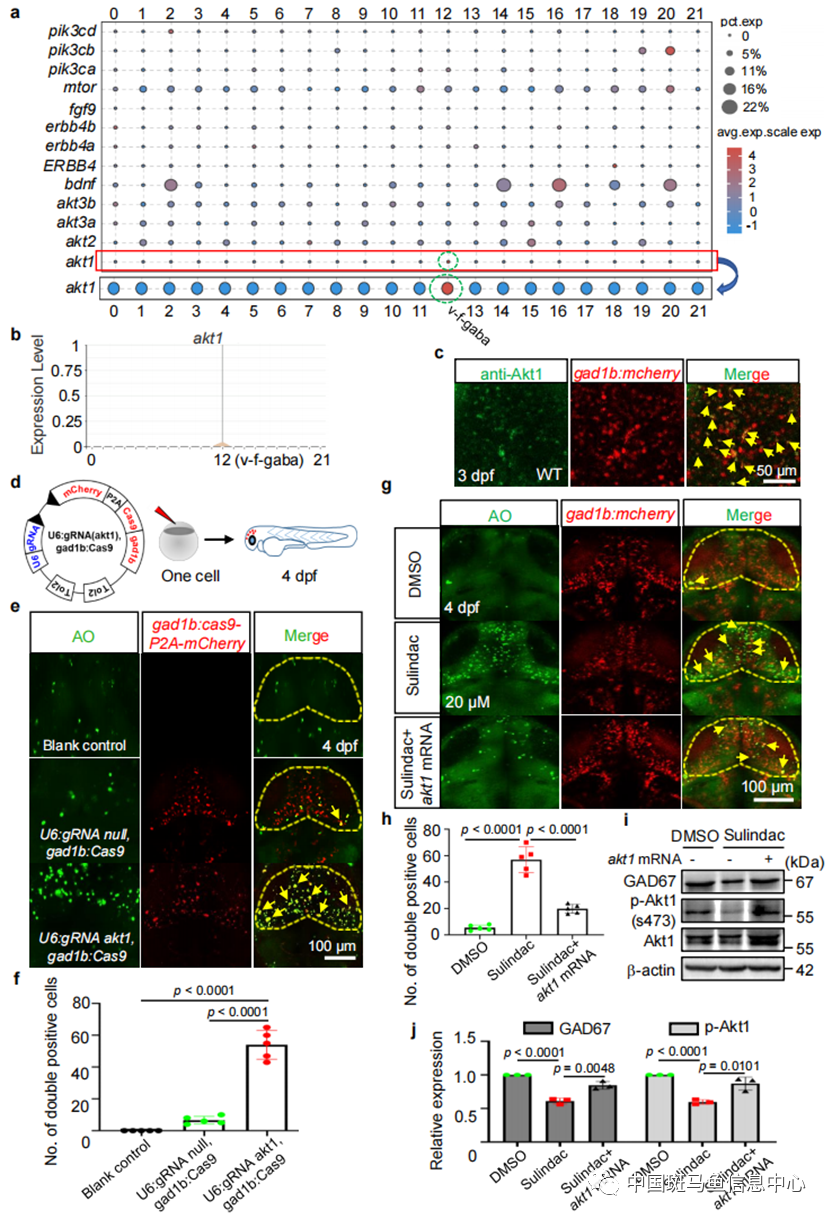
图2 Sulindac通过Akt1选择性诱导斑马鱼GABA能神经元凋亡

图2 Sulindac通过Akt1选择性诱导斑马鱼GABA能神经元凋亡
作者然后通过一系列分子筛选和验证实验,证实了sulindac可以通过激活bcl-2介导的线粒体凋亡通路,从而促进GABA能神经元自噬性细胞凋亡。此外,通过SEA Search Server数据库预测、分子对接以及pull-down实验,确认了sulindac与视黄酸X受体α(RXRα)结合,从而抑制PI3K-AKT1-mTOR信号通路(图3)。
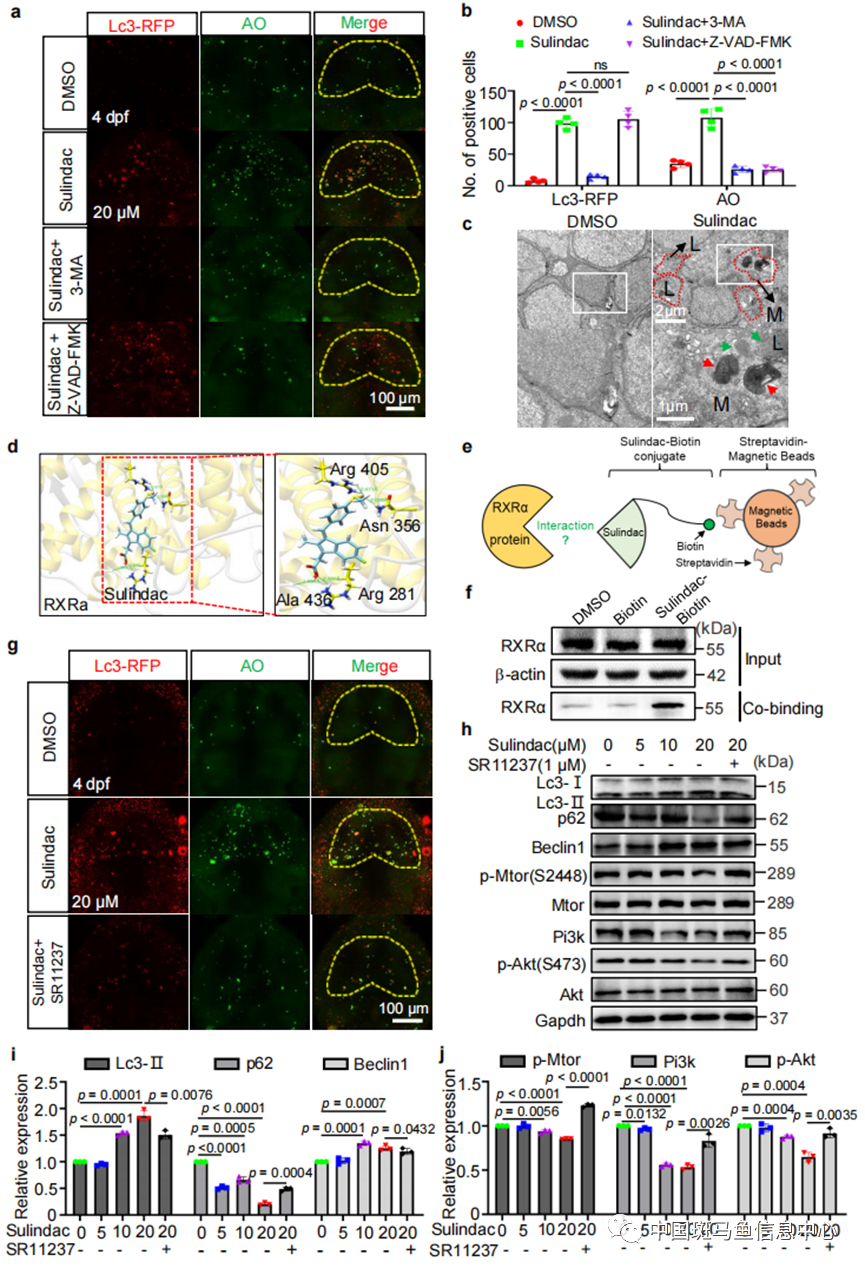
图3 Sulindac通过与RXRa结合抑制PI3K/AKT1/mTOR通路促进GABA能神经元自噬性凋亡

图3 Sulindac通过与RXRa结合抑制PI3K/AKT1/mTOR通路促进GABA能神经元自噬性凋亡
最后,作者发现与斑马鱼的观察结果一致,sulindac给药1个月后,26 mg/kg、52 mg/kg和104 mg/kg剂量的4周龄幼鼠也出现了显著的GABA能神经元的凋亡,而自主活动试验也发现小鼠表现出剂量依赖的活动性增加的现象。
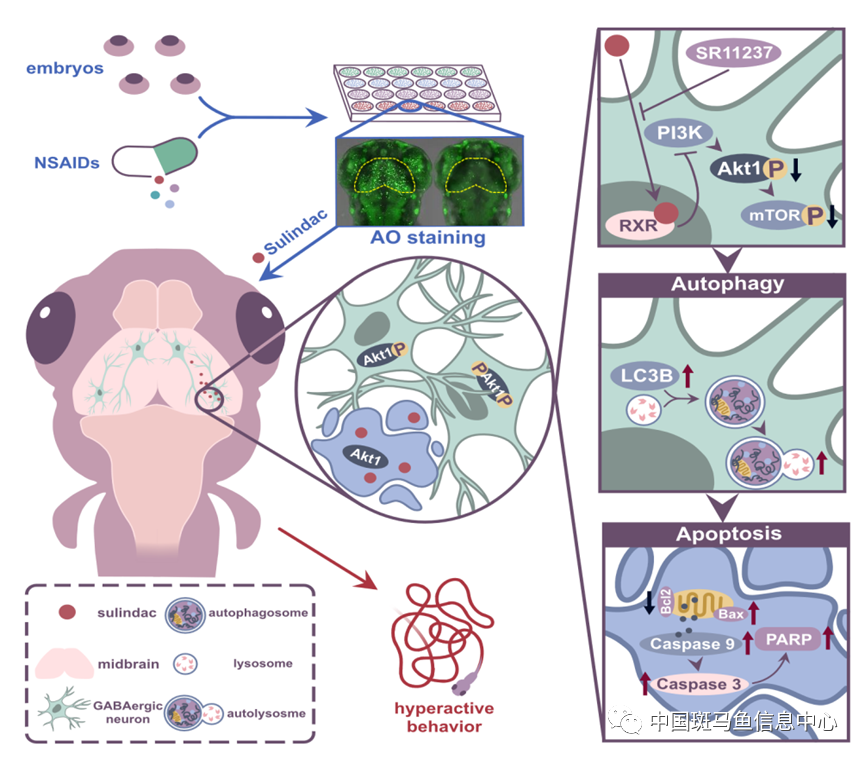
图4 工作模式图

图4 工作模式图
研究者认为这一发现对于有助于深入了解舒林酸等NSAIDs类药物对神经系统的作用。为我们更好地理解NSAIDs在早期神经系统发育过程中的作用开拓了新的视角,也为探索NSAIDs类药物在治疗神经精神类疾病方面的潜在应用提供了重要线索。
华南理工大学医学院孙文威和王梅梅博士并列本文的第一作者,张文清教授,黄志斌副教授以及广东药科大学的沈娟教授并列通讯作者。华南理工大学医学院为第一作者单位。本课题受到国家重点研发计划项目(2018YFA0801000)、国家自然科学基金项目(32170830)、广东省自然科学基金项目(2021A1515010422)和中央高校基本科研业务费(2022ZYGXZR031)资助。南方科技大学温子龙教授、华南理工大学王强教授、张美佳教授、高蒙教授、徐进教授、张译月教授和李健潮教授对本课题提供了重要的指导和建议。王卓副教授、李飞飞副教授和刘伟副教授在行为学实验和生信分析实验提供了帮助。华南理工大学医学院2018级本科生李畅同学参与本课题模式图的绘制。