张文清/刘伟团队发现靶向TNF/IL-17/MAPK通路可以缓解hE2A-PBX1白血病
作者:CZRC 发布时间:2024/2/27 9:00:00
t(1;19)(q23;p13)是白血病中最常见的染色体易位,导致5%-7%的儿童ALL和AML/MPAL。在ALL中,E2A-PBX1并非ALL的主要预后因素,但它与治疗反应差和缓解期短有关。E2A-PBX1易位的ALL患者复发风险很高,而且这种易位还与已知的高危临床特征有关。在AML中,基于散发性病例报告显示,E2A-PBX1阳性患者也表现出高风险的临床特征,包括高白细胞计数、高血清乳酸脱氢酶水平和中枢神经系统(CNS)受累。虽然最近的强化治疗方案和异基因造血干细胞移植改善了E2A-PBX1成人ALL患者的预后,但其全身毒性和高昂的费用也不容忽视。
t(1;19)(q23;p13)融合产生的E2A-PBX1蛋白结合了E2A的N端反式激活结构域(也称为 TCF3)和PBX1的C端DNA结合同源结构域。E2A作为B淋巴细胞生成的主要调节因子,决定了B细胞的谱系分化,并且在维持造血干细胞库和促进骨髓淋巴细胞和骨髓红细胞祖细胞的成熟方面也发挥着重要作用。PBX1是一种TALE(三氨基酸环延伸)转录因子,可与HOX家族的其他成员相互作用,增强其DNA结合特异性和亲和力。PBX1不仅在调节形态模式、器官发生和造血作用中发挥重要作用,而且还是调节发育基因表达的蛋白质复合物的重要组成部分。
已有报道通过在小鼠淋巴系统中特异性诱导E2A-PBX1的表达构建ALL疾病动物模型,以及体外通过逆转录病毒载体将E2A-Pbx1转导至小鼠髓系祖细胞中的AML模型。然而,由于缺乏条件诱导型且可用于药物筛选的E2A-PBX1的AML动物模型,导致E2A-PBX1介导AML发生的机制仍不清楚。更为重要的是,临床上仍然缺乏针对E2A-PBX1白血病的有效靶向药物。
2024年2月22日,华南理工大学医学院张文清/刘伟团队在学术期刊Haematologica上发表了题为:“Targeting TNF/IL-17/MAPK pathway in hE2A-PBX1 leukemia: effects of OUL35, KJ-Pyr-9, and CID44216842”的文章,该研究鉴定出了三种靶向TNF/IL-17/MAPK信号通路的小分子,包括OUL35、KJ-Pyr-9和CID44216842。这些小分子不仅缓解了斑马鱼中hE2A-PBX1诱导的髓系增生,还抑制了人E2A-PBX1相关pre-B ALL细胞的生长和致癌性。总的来说,这项研究提供了一个新的hE2A-PBX1转基因斑马鱼白血病模型,并鉴定了潜在的靶向治疗药物,为E2A-PBX1白血病的治疗提供了新的见解。


斑马鱼已被证明是研究造血系统疾病的优秀模型,尤其在广泛的治疗化合物筛选中。这是因为它们具有透明、体型小、寿命短(2-3年)、繁殖力强以及与人类遗传相似性高的特点。为了更好地理解E2A-PBX1诱导的白血病的机制并开发有效的靶向治疗方法,研究人员利用斑马鱼构建了一个可诱导的人源性E2A-PBX1白血病模型(图1A和B)。血液分析和生存分析显示,在胚胎早期诱导hE2A-PBX1表达,使得斑马鱼在幼鱼阶段展现出异常的髓系扩张(图1C和D),并在诱导hE2A-PBX1表达后15天内死亡(图1E)。详细的造血谱系检测以及增殖凋亡实验提示,hE2A-PBX1癌蛋白一方面增加HSPC的髓系分化潜力,另一方面诱导髓系增殖,从而导致异常的髓系扩张(数据未显示)。
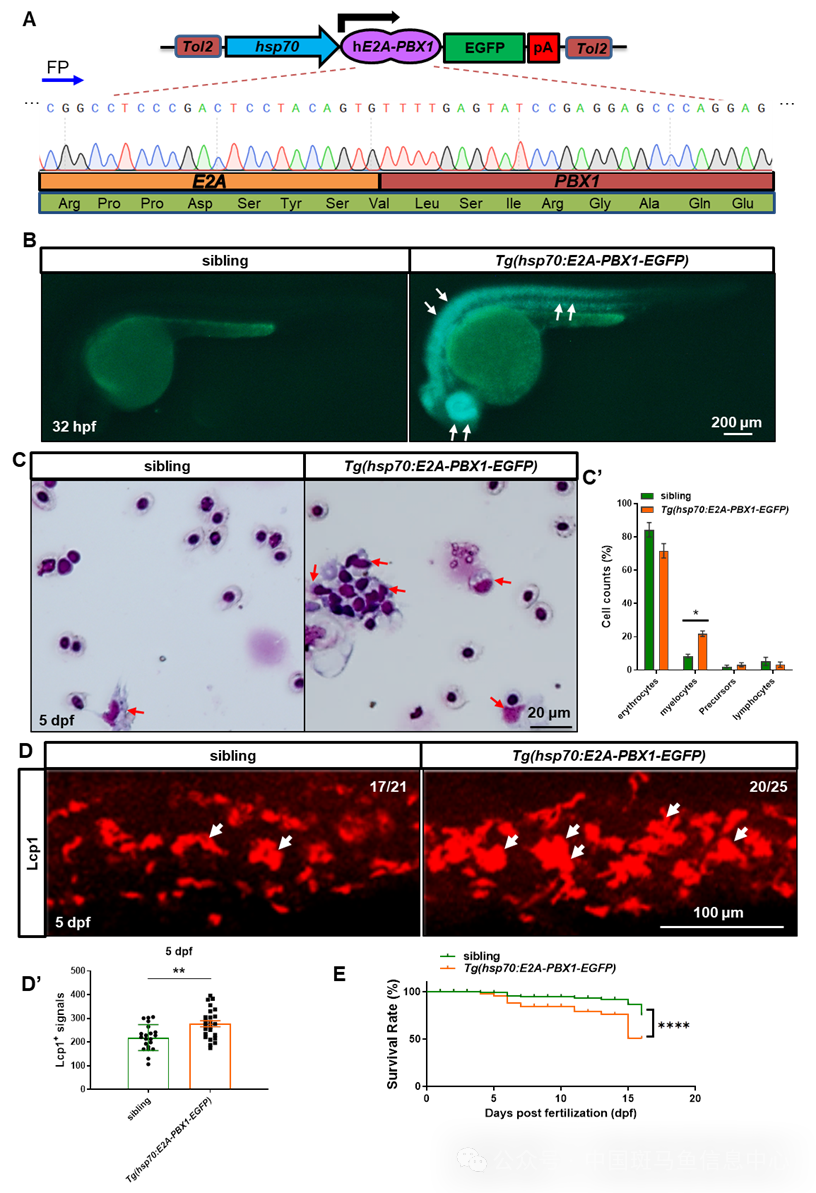
图1 人源性 E2A-PBX1 斑马鱼急性髓系白血病模型的构建及血液表型

图1 人源性 E2A-PBX1 斑马鱼急性髓系白血病模型的构建及血液表型
为了分析hE2A-PBX1的诱导表达是否会导致成年斑马鱼出现血液肿瘤,研究者对不同年龄(3月龄和1年龄)的Tg(hsp70:E2A-PBX1-EGFP)斑马鱼进行了不同时长(1个月以及3个月)的热激诱导,并观察它们血液表型变化。结果显示,随着斑马鱼年龄和hE2A-PBX1表达时间的增加,髓系增生、blast细胞增加、肾脏肿大以及非造血组织髓系细胞侵袭表型逐渐加重。这种AML样表型在1年龄的鱼连续诱导3个月hE2A-PBX1表达后尤为显著(图2A-D)。移植实验进一步证实了这些hE2A-PBX1衍生的髓系细胞的可移植性和恶性侵袭能力(数据未显示)。
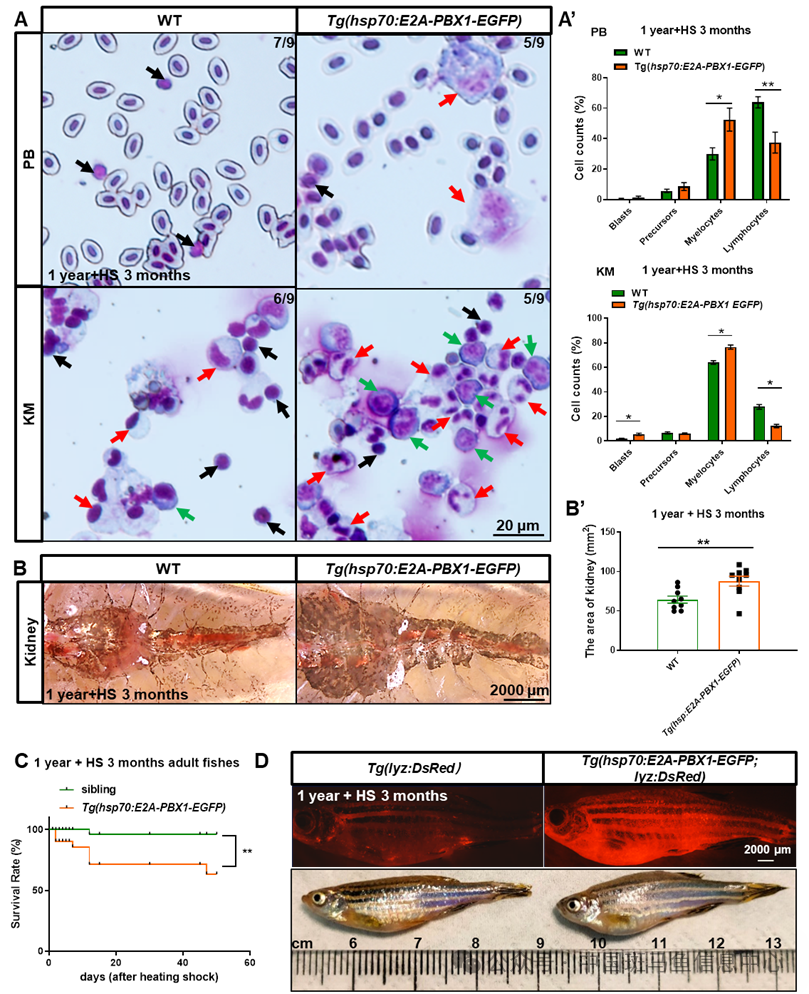
图2 成年斑马鱼中诱导hE2A-PBX1表达导致AML样表型

图2 成年斑马鱼中诱导hE2A-PBX1表达导致AML样表型
随后,研究者通过整体原位杂交、q-pcr以及拯救等实验证实了hE2A-PBX1融合蛋白通过上调runx1的表达诱导了髓系增生(图3A-C)。为了进一步探讨Runx1表达上调对hE2A-PBX1转基因系造血转录调控的影响,研究者对3月龄连续热激3个月的Tg(hsp70:E2A-PBX1-EGFP)肾脏血细胞进行了RNA测序分析。结果显示hE2A-PBX1斑马鱼中TNF/IL-17/MAPK信号通路富集(图3D),有10个基因在这些途径中显着上调(图3E)。而敲低runx1可以显著逆转hE2A-PBX1转基因系中hsp27、junb、socs3b、fosb和fosl1a的高表达(图3F),表明hE2A-PBX1可以通过上调runx1表达来诱导骨髓扩张并激活TNF/IL-17/MAPK信号通路。
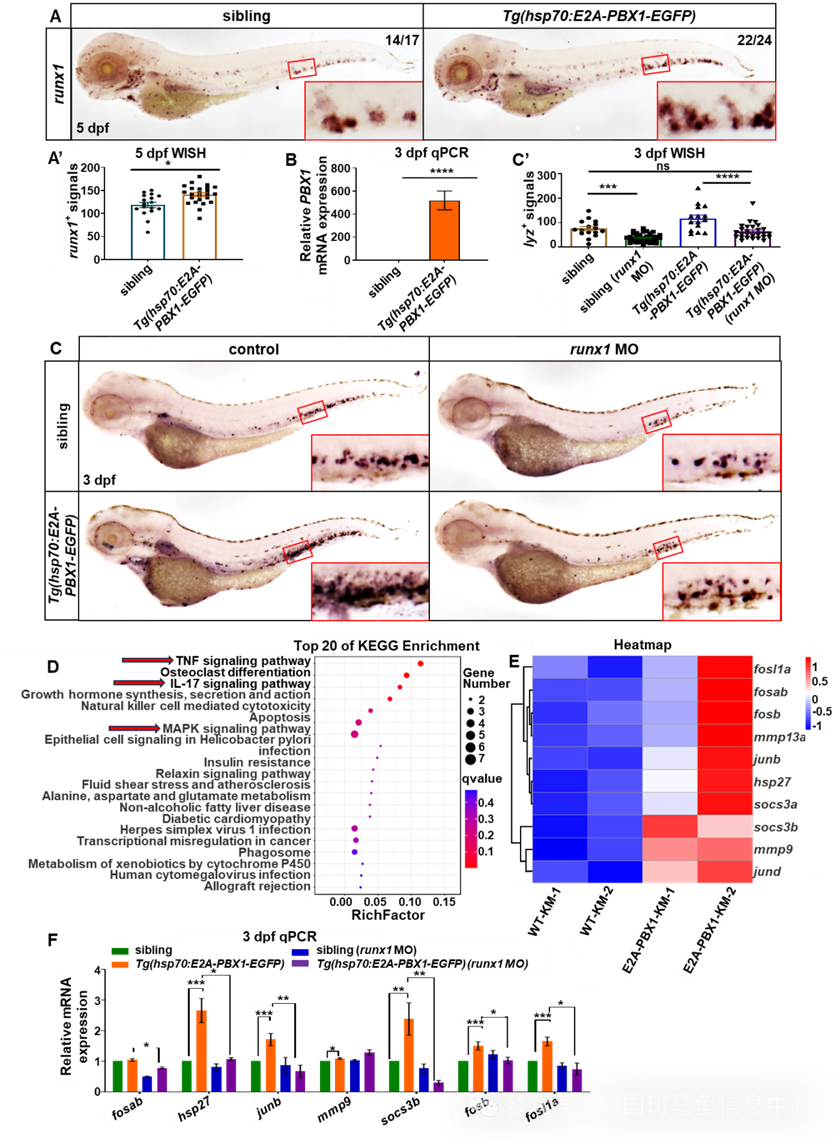
图3 hE2A-PBX1通过上调runx1表达诱导骨髓扩张并激活TNF/IL-17/MAPK信号通路

图3 hE2A-PBX1通过上调runx1表达诱导骨髓扩张并激活TNF/IL-17/MAPK信号通路
为了鉴定可以靶向hE2A-PBX1的小分子化合物,研究者利用Tg(hsp70:E2A-PBX1-EGFP)斑马鱼进行了高通量化合物筛选。有意思的是,研究者在筛选过程中发现了三种靶向 TNF/IL-17/MAPK 信号通路的小分子,包括 OUL35、KJ-Pyr-9和CID44216842,它们不仅能缓解 hE2A-PBX1 诱导的斑马鱼骨髓增生(图4A和B),还能有效抑制人E2A-PBX1相关pre-B ALL的致癌性(图4C和D)。
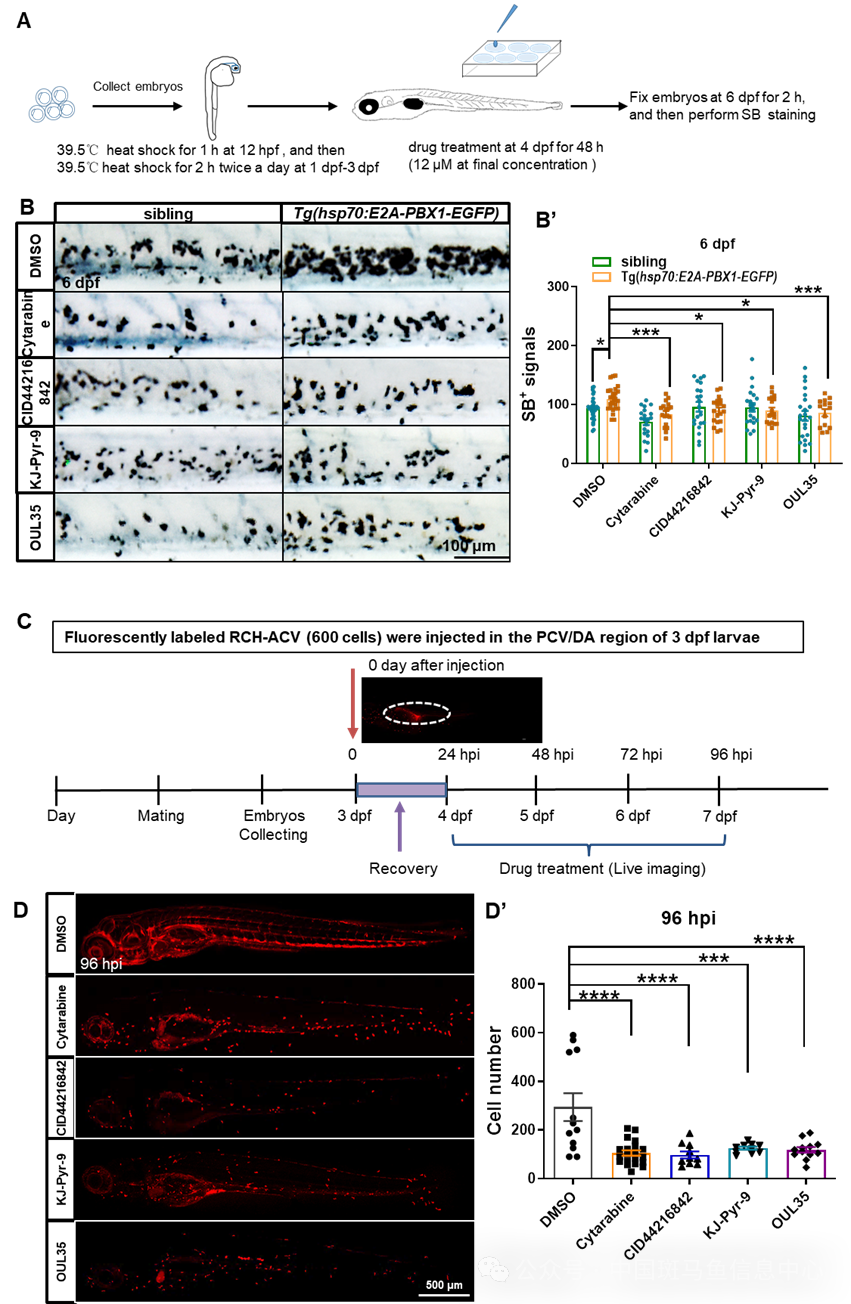
图4 OUL35、KJ-Pyr-9和CID44216842有效抑制hE2A-PBX1的致癌性

图4 OUL35、KJ-Pyr-9和CID44216842有效抑制hE2A-PBX1的致癌性
研究者认为这一发现有助于更深入地了解E2A-PBX1引起AML疾病的机制,并确定了几种有望用于靶向治疗的化合物。
华南理工大学医学院罗海萍和李崎崎硕士并列本文的第一作者,张文清教授,刘伟副教授并列通讯作者。华南理工大学医学院为第一作者单位。本课题受到国家自然科学基金项目(82070163)、广东省自然科学基金项目(2020A1515011218)和广东省大学生科技创新培育专项资金(pdjh2020b0048)资助。华南理工大学医学院谢华锋教授为本课题提供了RCH-ACV细胞。华南理工大学医学院李凯伦硕士、方潇博士、朱盼盼博士、赵爽博士和黄志斌副教授对本课题提供了帮助和建议。