梅奥诊所徐晓雷团队利用斑马鱼研究TITIN 扩心病的等位基因异质性并发现新的治疗靶点基因
作者:CZRC 发布时间:2024/4/19 10:00:00
截短型 TITIN 变异体(TTNtv)是扩张型心肌病(DCM)的一个主要遗传因素。但是,在人类 TTNtv 相关的 DCM 患者的基因图谱中发现了等位基因异质性(AH),即影响编码 C 端 A 带区域的外显子(TTNtv-A)的变异,比影响编码 N 端 Z 带区域的外显子(TTNtv-Z)更有可能是致病的。AH的存在, 严重干扰了TTNtv-DCM的基因诊断和治疗。引起 TTNtv-DCM 的 AH 特点背后有三种可能的机制,包括单倍体剂量不足假说(截短型 TTN 蛋白致外显子失用及功能缺失)、毒性肽假说(截短型 TTN 蛋白插入导致有害蛋白产生)和 Cronos 假说(一种在临床病例中发现的短 TTN 亚型)。然而,目前这一现象尚未能在动物模型中建模成功,而只在诱导多能干细胞(iPSC)模型的研究中模拟出了 AH 现象,这在一定程度上制约了对 TTN 相关心肌病发病机制的研究. 在最近的一项 TTNtv-DCM 大鼠模型的信号通路分析中,发现了自噬调节异常是 TTNtv-DCM 的一个潜在的致病通路,但调节自噬是否可以作为治疗TTNtv-DCM的方法还不清楚. 斑马鱼是近年来新兴的研究扩心病的动物模型,具有独特的遗传学优势。那么斑马鱼TTNtv-DCM模型是否存在具有 AH 特点的自噬失调?如何筛选调节自噬功能的基因以及将调节自噬用于治疗 TTNtv-DCM 的获益有多少?这都是值得在斑马鱼模型中进行探讨的问题。
2024 年 2 月 27 日,梅奥诊所徐晓雷团队在 JCI Insight上发表了题为“Allelic heterogeneity of TTNtv dilated cardiomyopathy can be modeled in adult zebrafish”的文章,该研究通过研究一系列 ttntv-A 和 ttntv-Z 斑马鱼突变体,探究 TTNtv-DCM 的等位基因异质性是否可以在斑马鱼中建模实现以及检测 ttntv-DCM 斑马鱼模型中的自噬失调表现,并进一步研究是否可以通过调节自噬水平对 ttntv-DCM 施加治疗效果。
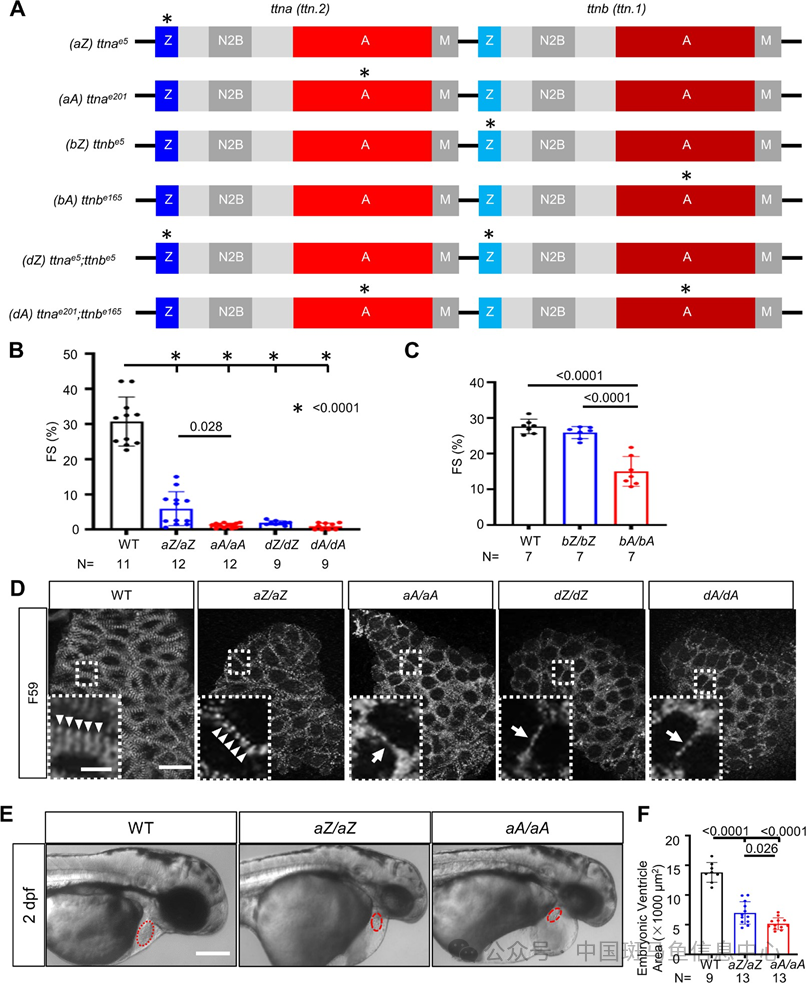
图1 斑马鱼突变体的构建及胚胎期 aA/aA 相较 aZ/aZ 心脏功能缺损表型更为显著
为了模拟出 ttntv-DCM的 AH 特性,研究团队首先利用 TALEN 技术在斑马鱼中构建了一系列 ttntv-A 和 ttntv-Z 突变体(图 1A),分别观察胚胎期以及成鱼期不同月龄阶段的表型。研究发现胚胎期纯合子状态下,相比 aA/aA 全部胚胎都出现 FS 下降、心肌肌节缺损和心室缩 小,aZ/aZ 有一半的胚胎可以维持相对正常的FS(图 1B),同时部分胚胎可以维持正常的心肌肌节结构(图 1D)和心室大小(图 1E-F),bA/bA 与 bZ/bZ 相比也有 FS 的下降(图 1C)。而在分别对 3、6、12 月龄的成鱼杂合体进行心脏超声检测时则发现,相较于 ttntv-Z 突变体能维持与 WT 相似的正常心功能,dA/+和 aA/+在 3 月龄时开始出现EF%下降,bA/+则在 12 月龄时出现EF%下降(图2A-C),心功能不全具体表现为收缩末期容积(ESV)的增加和心室的扩大(图 2D-F),这些都是扩张型心肌病的典型心脏表型。同时期也出现 nppa 这一象征心肌重构的标志物表达升高(图 2G),通过对斑马鱼游泳能力的检测也发现 dA/+出现了活动能力的下降(图 2H),象征心肌病导致的活动受限,但需注意的是 dZ/+在这两项检查没有表现为完全正常,这侧面说明ttntv-Z不完全是良性的突变。在更年长的斑马鱼中,研究团队发现 dA/+会表现出心肌纤维排列紊乱(图 2I),这是一个新的病理事件,在一定程度上能解释扩心病患者心肌应变下降的原因。至此,研究团队成功构建了模拟 AH 现象的ttn-DCM 斑马鱼模型。
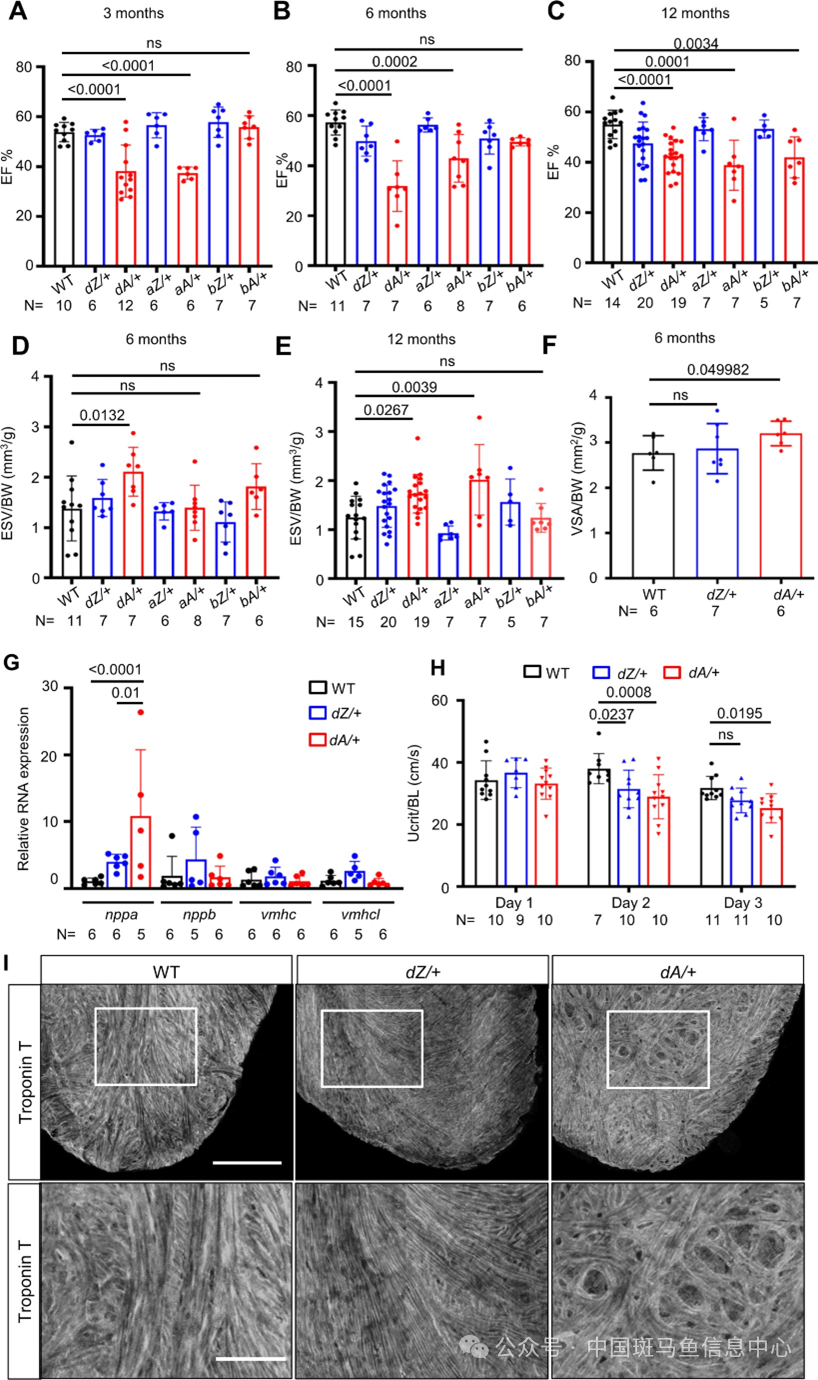
图2 ttn-DCM 斑马鱼成鱼期 ttntv-A 较ttntv-Z 出现更明显的心功能不全表现
接下来研究团队用 Crispr-Cas9技术构建了全长 ttn 敲除的斑马鱼模型(图 3A),在 ttn蛋白凝胶中发现随着 aA/aA、a-null/a-null、d-null/d-null敲除部分的逐步增加,功能缺失逐步加重,ttn 蛋白的浓度也逐渐减少至完全消失(图 3B);通过观察表型发现,d-null/d-null 表现出胚胎期心肌肌节缺损(图 3C),成鱼期 EF%下降(图 3D-F)等,表现贴近于 ttntv-A 而不是 ttntv-Z。这些新发现一方面重申了 AH 的特点,另一方面更重要的是强调了单倍体功能不足假说中的功能缺失理论。研究团队认为单就外显子失用功能缺失而言,即足够引起ttn-DCM 的表型。
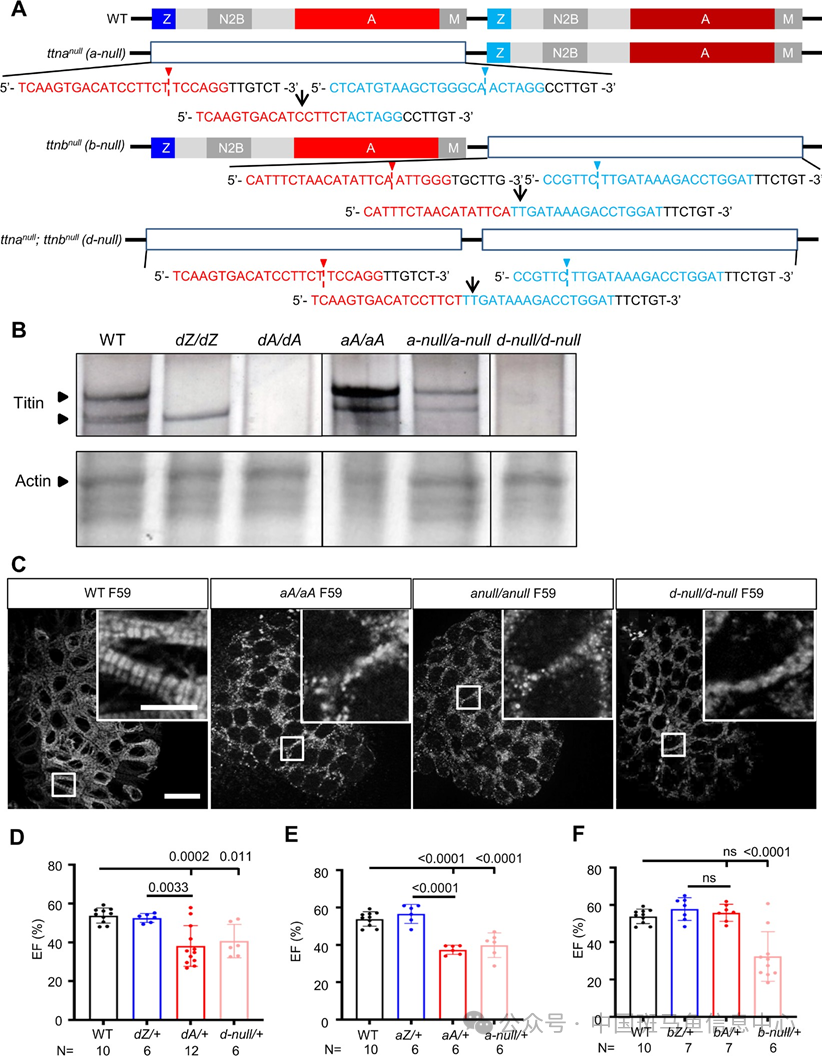
图3 ttn-null 突变体的构建及其表型贴近于 ttntv-A 而不是 ttntv-Z
研究团队接着呈现的是自噬功能的检测部分,他们利用胚胎注射技术以及 MMEJ 原理,在斑马鱼胚胎中注射入 pBABE-puro-mCherry-EGFP-LC3II质粒,分别在施加与不施加 BafA1情况下计算心肌细胞周围LC3 puncta 的量,以衡量自噬基础水平和自噬流的变化。研究发现在成鱼期,无论是3 月龄还是 12 月龄,dA/+都同样表现出以上的自噬调控异常现象,dZ/+大致正常(图 4A-B),研究者从而推测 dZ/+可能具备不一样的自噬调控机制。胚胎期 dA/dA 出现自噬基础水平的升高及自噬流的受损,而 dZ/dZ 的自噬功能是正常的(图 4C-D)。在更深入的研究中,通过对 LC3-tandem 的鱼胚胎进行 LAMP1 免疫染色发现 dA/dA 的 LC3-LAMP1 共染降低(图 4F-G),提示自噬体-溶酶体融合功能受损,至此,研究团队已发现了 ttn-DCM 斑马鱼在观察周期内一致性地表现出具有 AH 特点的自噬失调,这种缺陷反映在自噬体-溶酶体融合功能中,影响了自噬流。
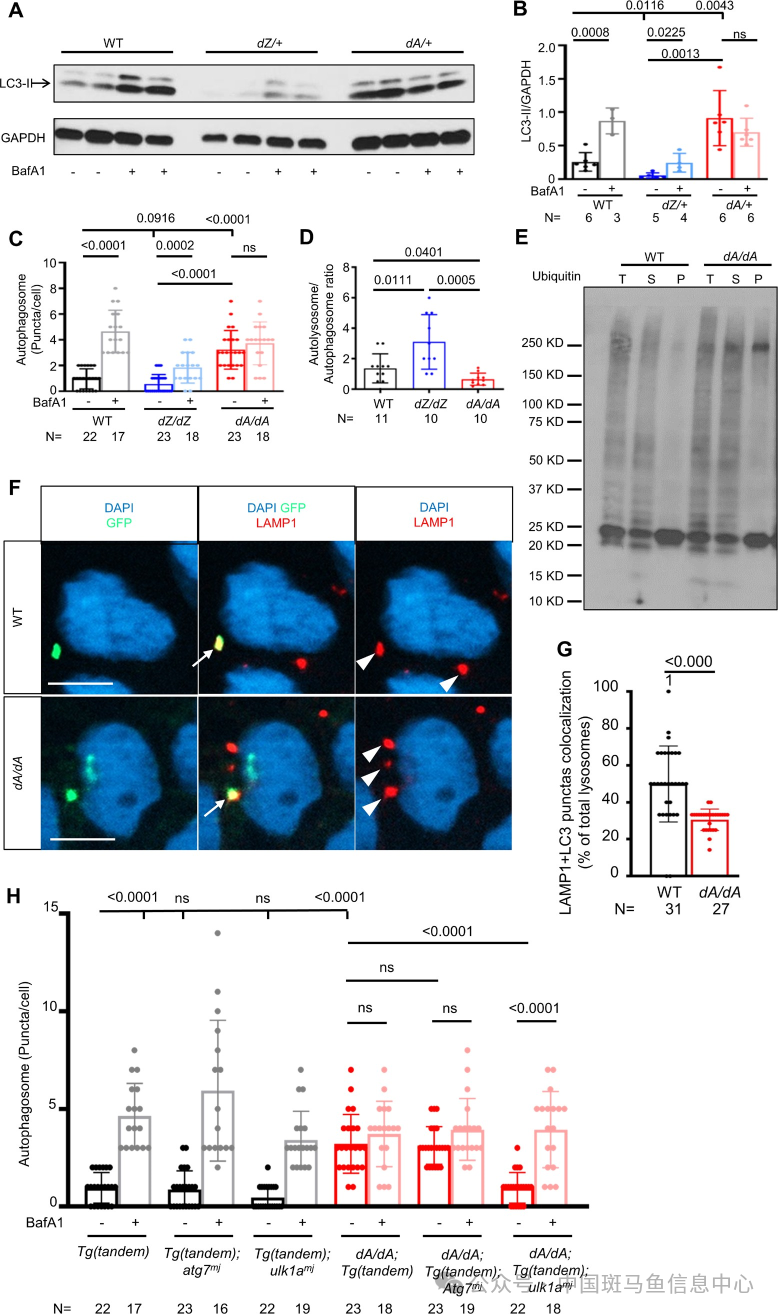
图 4 胚胎期及成鱼期 ttntv-A 出现自噬基础水平升高和自噬体融合功能缺陷及利用这一特征建立的候选治疗基因筛查平台
为了探讨是否可以通过修复自噬功能达到恢复心功能障碍,研究团队构建了一个基于上述评估胚胎自噬水平的候选自噬相关基因筛选平台(图 4H),通过比较何种基因的的敲低能恢复 dA/dA 胚胎中的自噬失调,他们选定了 ulk1a 作为研究对象,继续构建 dA/dA;ulk1amj双突变体并稳定传代。通过对 F2 的胚胎期和成鱼期相关表型的观察,他们发现 ulk1a 的敲低处理可以修复胚胎期(图 5A-B)和成鱼 3 月龄期(图 6A-B)的自噬失调、恢复正常的自噬流,自噬体融合功能也得到恢复(图5C-D)。也能修复出现心肌细胞核增大(图 5E、H)、心室形态异常(图 5E、F)和 FS 异常的胚胎(图 5G)、恢复一部分心肌肌节结构(图 5E),在成鱼期恢复正常的 EF%(图 6C)和有效降低 nppa 的异常表达(图 6D),修复在 dA/+中异常高表达的 atg7 和 ulk1a(图6E-G)。
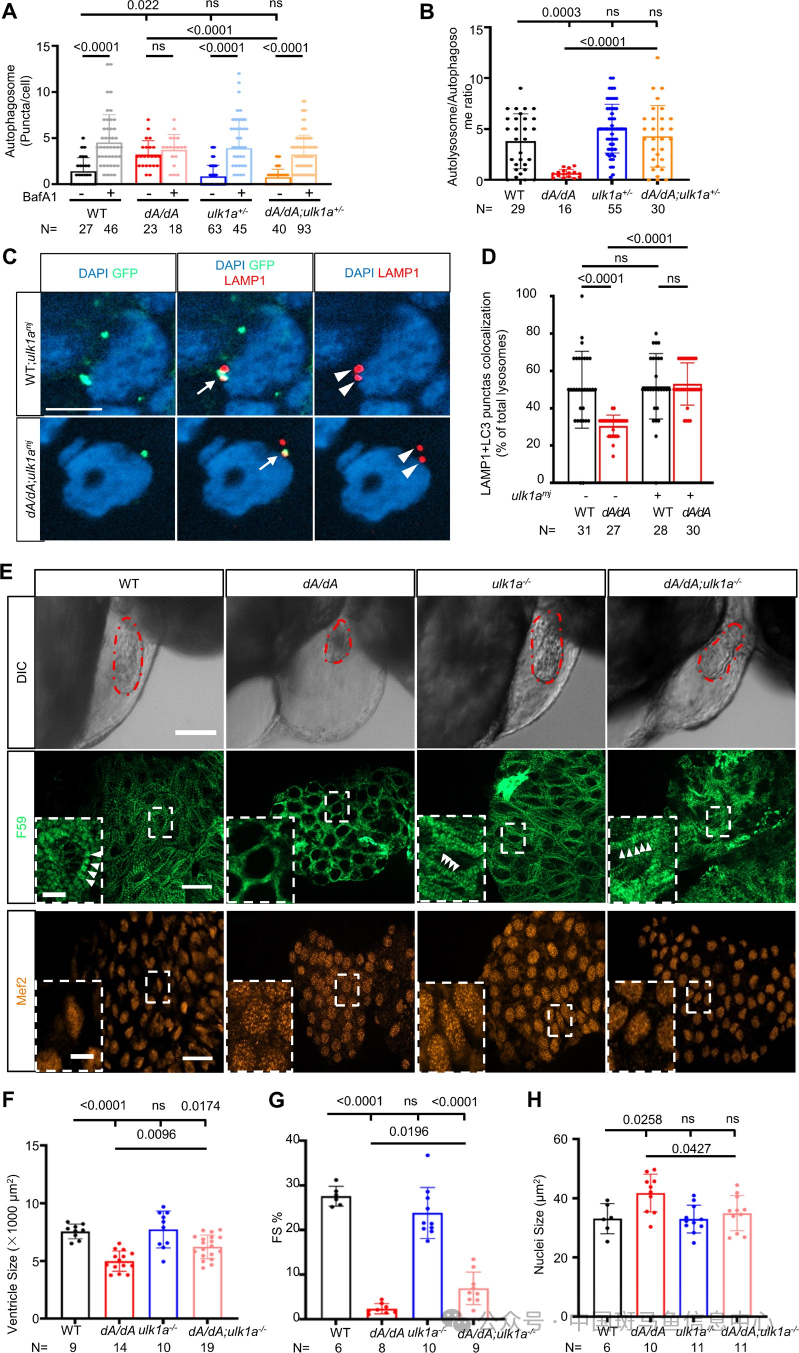
图5 抑制ulk1a 表达修复自噬调节缺陷以及在胚胎期修复心脏结构与功能缺损
研究者认为ttn-DCM 斑马鱼模型的构建为日后深入研究ttn心肌病提供了平台,成功通过修复自噬功能从而修复心功能障碍的发现也为基因治疗扩张型心肌病提供了良好的思路。基于Ulk修复自噬功能的治疗方法能否拓展至其他类型心肌病,是未来值得研究的课题。
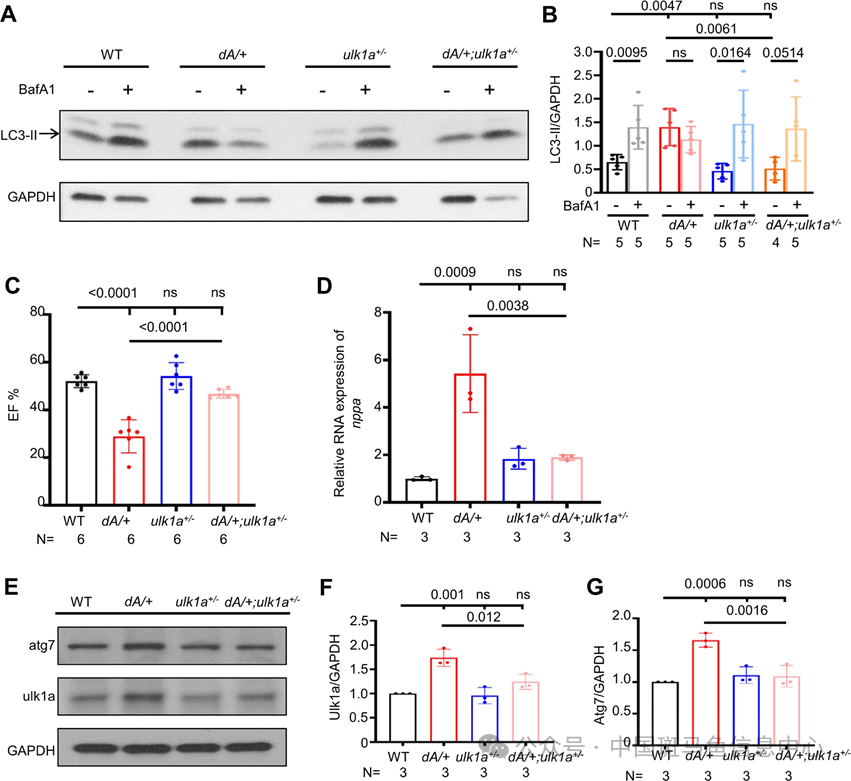
图6 抑制ulk1a 表达修复成鱼期的自噬调节缺陷及心功能障碍,下调异常自噬相关蛋白表达
Mayo Clinic 心血管科的Zhu Ping 博士和中南大学湘雅二医院心血管外科李嘉荣博士并列本文的第一作者,徐晓雷教授为通讯作者。